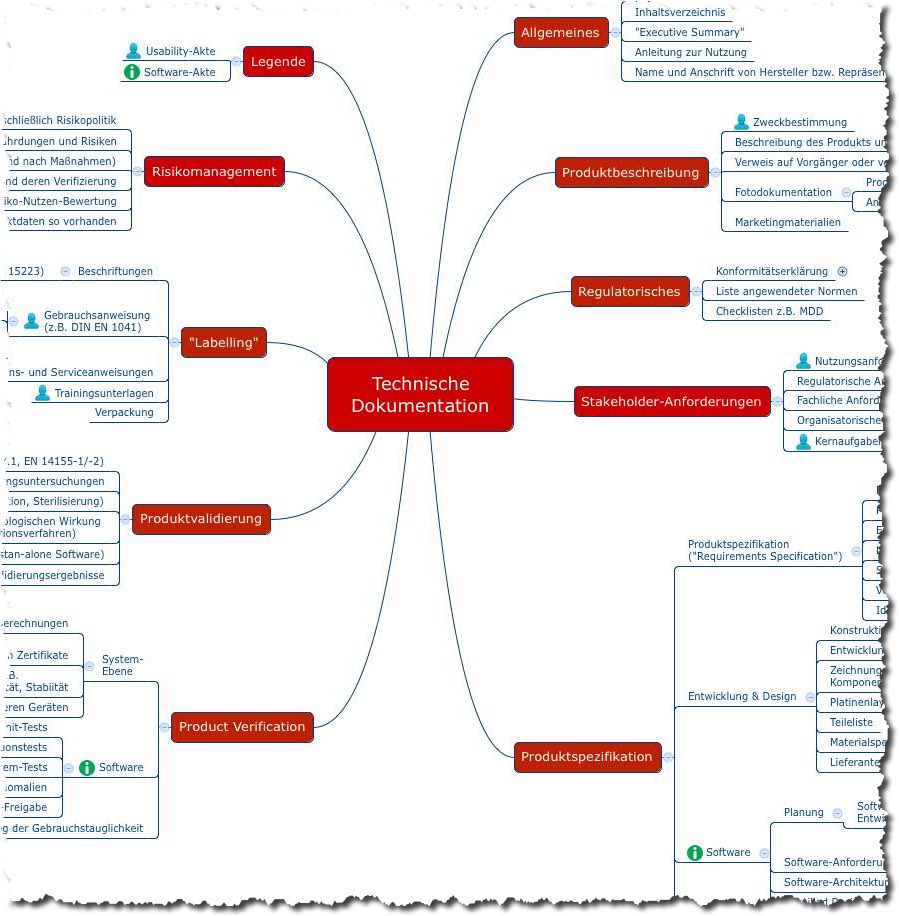
Heuristische Evaluation von Medizinprodukten
Die heuristische Evaluation ist ein Verfahren, mit dem Usability-Experten die Gebrauchstauglichkeit von Produkten anhand von Heuristiken (dazu gleich mehr) beurteilen. Dieser Artikel zeigt, wie Sie heuristische Evaluationen nutzen können, um die regulatorischen Anforderungen ans Usability Engineering sehr schnell und kostengünstig zu erfüllen. Er verrät Ihnen auch, weshalb Sie die heuristische Evaluation nicht auf das (Medizin-)Produkt…
Weiterlesen