Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Das De-Novo-Verfahren, die FDA spricht auch vom „de novo program“ und vom „de novo submission process“, ist eines der Zulassungsverfahren für Medizinprodukte in den USA. Dieses Verfahren können Hersteller für neuartige Produkte anwenden – wie der Name „de novo“ bereits vermuten lässt. Hersteller sollten also einen De-Novo-Antrag für ein Produkt stellen, für das es kein…
Details
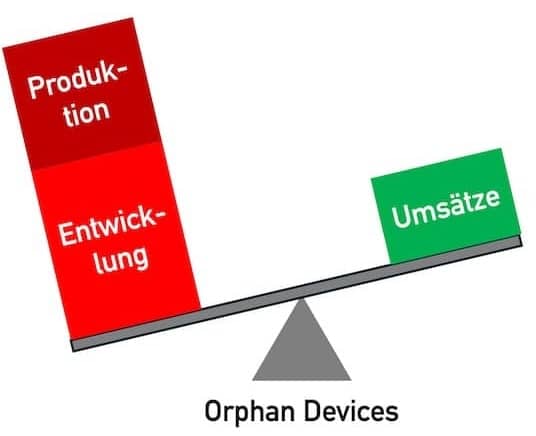
Orphan Medical Devices sind Medizinprodukte (und IVD) für kleine Patientengruppen. Die Entwicklung dieser Nischenprodukte rechnet sich für die Hersteller oft nicht. Das führt dazu, dass besonders vulnerable Gruppen wie Kinder nicht immer ausreichend medizinisch versorgt werden können. Dieser Artikel zeigt Lösungsansätze auf und ordnet die Leitlinie MDCG 2024-10 ein.
Details
Klinische Studien in Australien durchzuführen, haben viele Medizinproduktehersteller nicht auf dem Schirm. Dabei gibt es gute Gründe, für klinische Studien bzw. klinische Prüfungen auch diesen Kontinent in Betracht zu ziehen. Hersteller sollten dann aber auch die regulatorischen Anforderungen Australiens und spezifische Nachteile kennen.
Abweichungen, Nichtkonformitäten, Fehler, Findings und weitere Begriffe werden fälschlicherweise oft synonym verwendet. Sogar Normen widersprechen sich bei der Definition einzelner Begriffe explizit. Dieser Artikel klärt,
Details
Eine „FDA Registration“ ist eine gesetzlich vorgeschriebene Eintragung von „Establishments“ (wie Medizinprodukteherstellern) in eine FDA-Datenbank. Die FDA Registration darf nicht mit der UDI-Registrierung in der GUDID-Datenbank oder gar einer FDA-Zulassung verwechselt werden. Dieser Artikel beantwortet die wichtigsten Fragen und hilft, die häufigsten Fehler bei der FDA Registration zu vermeiden.
Details
Unternehmen müssen die digitale Transformation schnell und erfolgreich bewältigen. Das gilt auch für Medizinproduktehersteller. Denn ihre Zukunft hängt davon ab. Bei dieser Transformation begehen viele Unternehmen folgenreiche Fehler (s. 4. Abschnitt). Daher gibt dieser Fachartikel insbesondere Führungskräften einen schnellen Überblick über die Möglichkeiten der digitalen Transformation. Sie erhalten sieben Tipps, damit diese zum Erfolg wird.…
Details
Das Breakthrough Devices Program ist ein Zulassungsverfahren für Medizinprodukten, mit dem die FDA schwerstkranken Patienten einen schnelleren Zugang zu neuartigen Medizinprodukten ermöglichen möchte. Die Behörde hat dazu im Dezember 2018 ein „Guidance Document“ veröffentlicht. Sie erfahren in diesem Artikel,
Details
Eine FDA-Inspektion ist für viele Hersteller von Medizinprodukten mit großem Stress verbunden. Viele Firmen kennen die möglichen Konsequenzen wie einen öffentlichen Warning Letter und gar eine strafrechtliche Verfolgung. Aber sie wissen oft nicht, wie sie diese Konsequenzen sicher vermeiden können, ohne tagelang das ganze Unternehmen stillzulegen. Dieser Artikel zeigt, wie So wird eine FDA-Inspektion für…
Details
Phantome in der Medizintechnik helfen, Medizinprodukte schneller und wirkungsvoller zu validieren, „zuzulassen“ und in den Märkten zu überwachen. Dieser Artikel beschreibt, welche Organisationen besonders vom Einsatz dieser Phantome profitieren und welche Voraussetzungen sie dafür erfüllen müssen.
Details
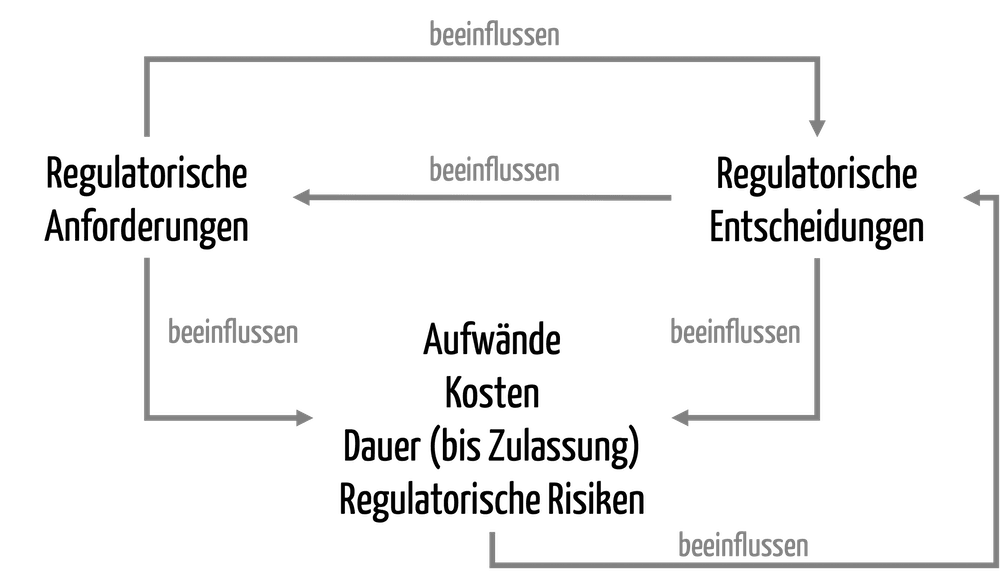
Die regulatorische Strategie festzulegen, zählt zu den zentralen Aufgaben der Regulatory-Affairs-Abteilungen bei Medizinprodukteherstellern. Weshalb ist eine gute regulatorische Strategie so wichtig? Was müssen die Regulatory Affairs Experts tun? Antworten liefert dieser Artikel.
Details