Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Der Begriff ‚Predicate Device‘ fällt meist im Kontext von 510(k)-Zulassungen der FDA. Allerdings definiert die FDA diesen Begriff nicht. Sie legt hingegen fest, was ‚Substantial Equivalence‘ ist. Klingt kompliziert? Der Nachweis der Äquivalenz ist keinesfalls nur im Kontext der FDA relevant. Deshalb verschafft dieser Artikel Klarheit – gerade, aber nicht nur für Hersteller, die ihre…
Details
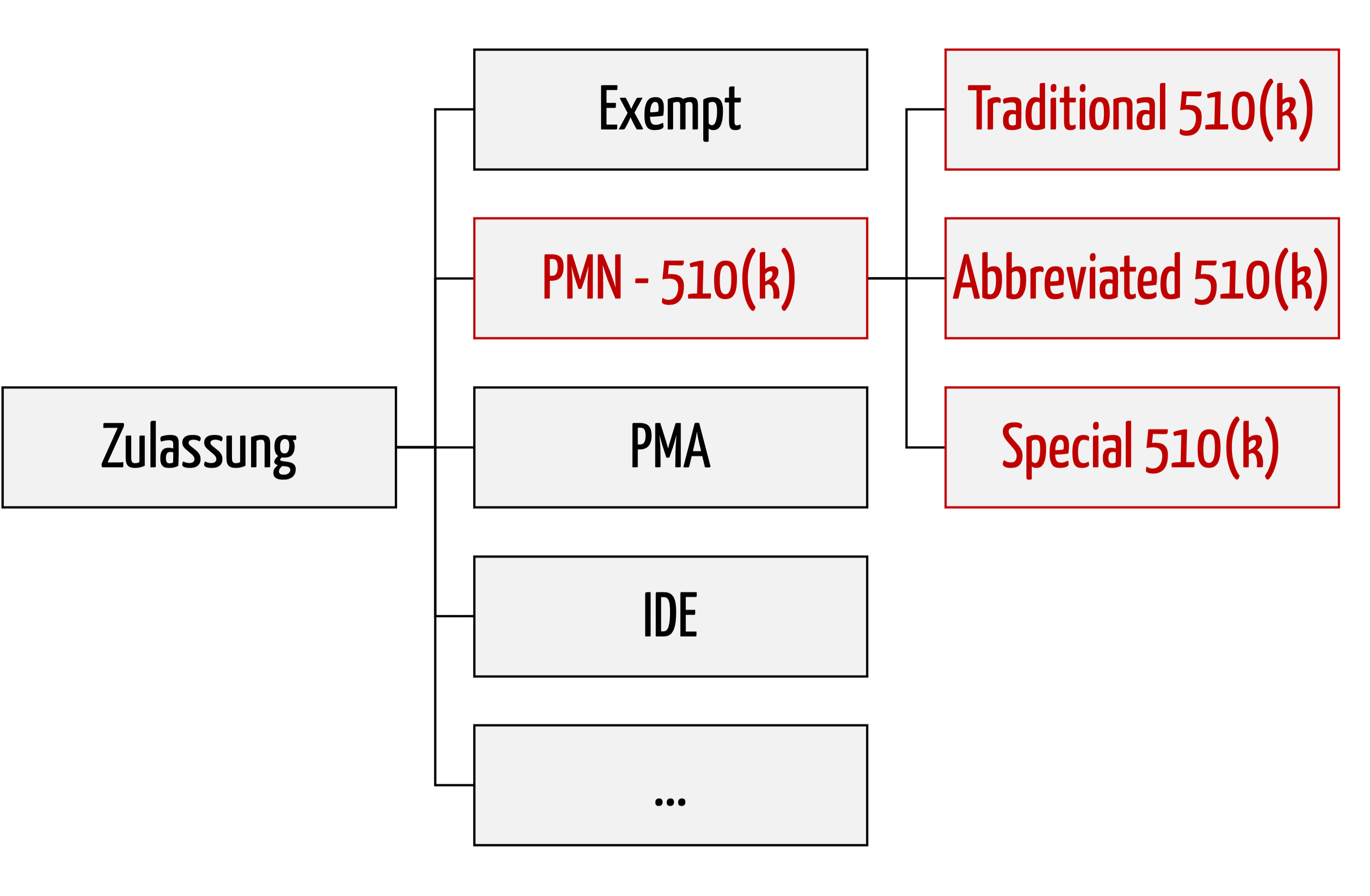
Die 510(k)-Zulassung ist das wichtigste Verfahren, um Medizinprodukte in den USA zuzulassen. Es wird auch als Premarket Notification (PMN) bezeichnet. Dieser Artikel verschafft eine schnelle Übersicht über das Verfahren und die Dokumente, die einzureichen sind.
Details
Die Branchenanalyse Medizintechnik aus dem Jahre 2020 veranschlagte den Markt für Medizinprodukte in Südkorea auf 6,7 Mrd. USD. Aufgrund einer jährlichen Wachstumsrate der Importe von (geschätzt) 10 % und der zunehmenden Überalterung der Bevölkerung bei gleichzeitigem Anstieg der medizinischen Grundversorgung ist mit einem kontinuierlichen Wachstum des südkoreanischen Markts zu rechnen. Dieser Beitrag zeigt auf, welche…
Details
Medizinproduktehersteller haben hohe Erwartungen an Regulatory Information Management Systems (RIMS). Kosten und Aufwände dafür sind immens und meist viel höher als geschätzt. Der Nutzen steht hingegen nicht fest. Dieser Artikel liefert Ihnen die entscheidenden Hinweise,
Details
Regulatory Intelligence halten viele Firmen für so wichtig, dass sie dafür eigene Rollen und Abteilungen schaffen. Dieser Artikel klärt, was Regulatory Intelligence ist, welchen Nutzen Firmen davon haben und wo Tools unterstützen können. Er enthält einen Podcast, in der eine Führungskraft aus dem Bereich Regulatory Intelligence Einblick in ihren Arbeitsalltag gibt.
Details
Medizinprodukte-Zertifizierung, MPG-Zertifizierung, MDR-Zertifizierung, CE-Zertifizierung. Das sind Begriffe, die oft verwendet werden. Aber gibt es überhaupt so etwas wie eine Medizinprodukte-Zertifizierung? Dieser Artikel beantwortet die Frage.
Details
Das IMDRF (International Medical Device Regulators Forum) möchte zur Harmonisierung der international unterschiedlichen Vorschriften beitragen und dadurch die Zulassung von Medizinprodukten vereinheitlichen und vereinfachen. Dazu veröffentlichen die Freiwilligen des IMDRF Leitfäden, die zwar nicht verbindlich sind, aber Hilfestellungen geben. Dieser Artikel stellt Ihnen ausgewählte Leitfäden vor.
Details
Die Türkei ist kein Mitgliedstaat der EU, hat aber ihre regulatorischen Anforderungen an Medizinproduktehersteller den EU-Anforderungen angeglichen. Dieser Artikel beschreibt,
Details
Von 2017 bis 2022 bot die FDA ausgewählten Firmen für standalone Software ein „Precertification (Pre-Cert) Pilot Program“ an, das den Zulassungsprozess von Digital Health Produkten vereinfachen und beschleunigen sollte. Weiterführende Informationen Auf Ihrer Webseite informiert die Behörde ausführlich darüber. Dieser Artikel fasst Ihnen die wichtigsten Aspekte zusammen und verschafft Ihnen einen schnellen Überblick.
Details
510(k)-Verfahren, auch “Premarket Notification” genannt, gehören zu den gängigsten Verfahren, nach denen in den USA Medizinprodukte zugelassen werden. Das Konzept basiert darauf, die Äquivalenz mit einem Vergleichsprodukt nachzuweisen. Doch dabei passieren schnell die immer gleichen Fehler, an denen die gesamte 510(k)-Zulassung scheitern kann. Das muss nicht sein! Erfahren Sie in diesem Beitrag, welches die fünf…
Details