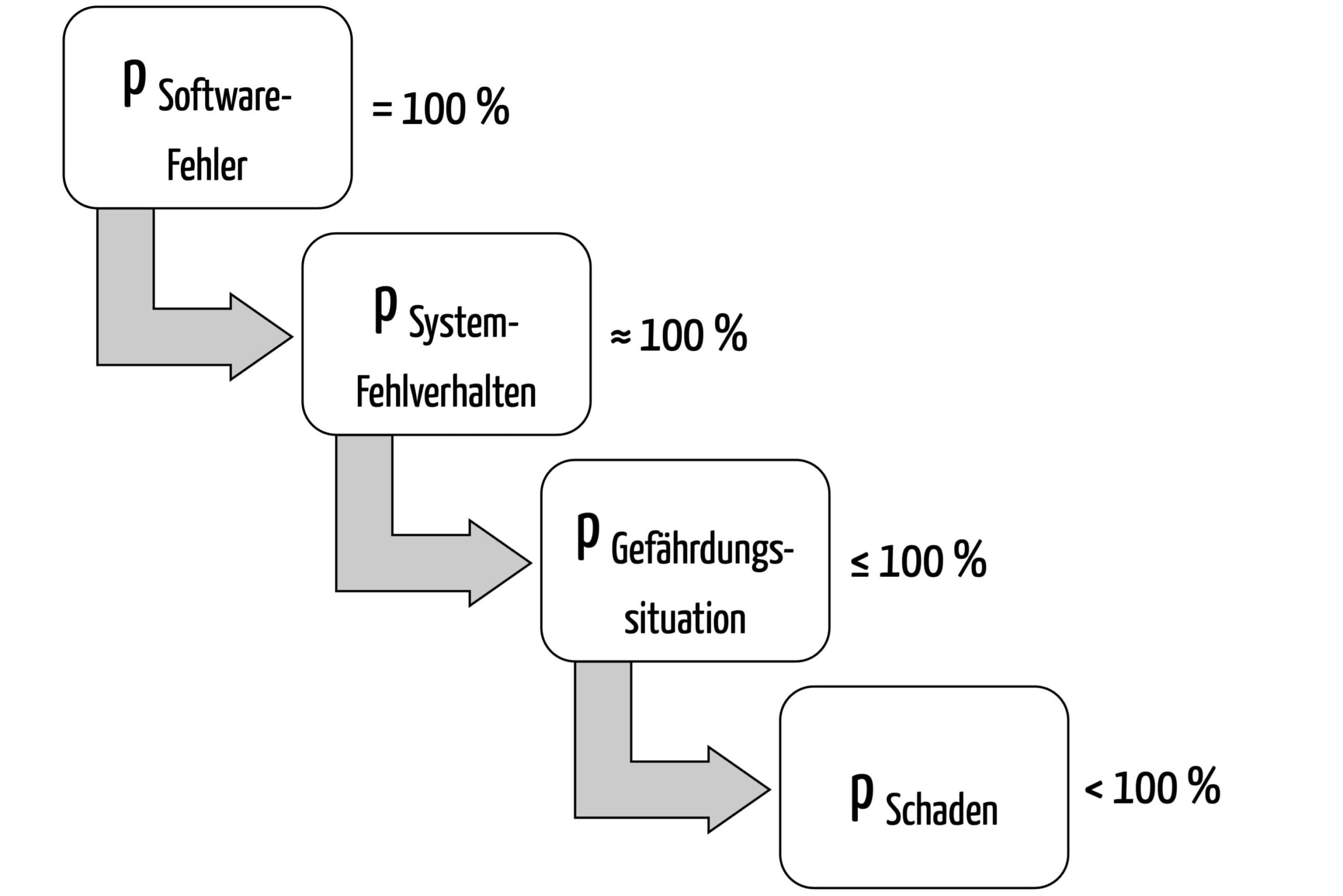
Die IEC 62304 ist eine in Europa harmonisierte1 Norm für „Medizingeräte-Software“. Sie trägt den Titel „Medizingeräte-Software – Software-Lebenszyklus-Prozesse“ und stellt Mindestanforderungen an Prozesse wie die Entwicklung und Wartung der Software.
Inhalt
Sie finden auf dieser Seite:
- Fachartikel zu den Aspekten der IEC 62304
- Fachartikel zu den Lebenszyklus-Aktivitäten
- Fachartikel zur regulatorischen Bedeutung der IEC 62304
- Hinweise, wo und wie Sie Hilfe bei der Umsetzung erhalten
1 Die IEC 62304 war unter der MDD und IVDD harmonisiert und ist unter der MDR und IVDR zur Harmonisierung vorgesehen.
1. Artikel zu Aspekten der IEC 62304
a) Anwendungsbereich
Die IEC 62304 ist anwendbar bei
- eigenständiger (Standalone-) Software, die als Medizinprodukt zählt (Software as Medical Device), wie
- Software, die Teil eines Medizinprodukts ist (Software in a Medical Device).
Weil die IEC 82304-1 die Norm referenziert, ist die IEC 62304 sogar bei Health Software relevant.
b) Regulatorischer Kontext
Qualifizierung und Klassifizierung
Beachten Sie auch die Fachartikel zu den Lebenszyklus-Aktivitäten unter Punkt 2.
Besondere Anforderungen an Software
c) Konzepte der Norm
2. Artikel zu den Lebenszyklus-Aktivitäten
Die folgenden Artikel sind nach den Kapiteln der IEC 62304 gruppiert.
Kapitel 5.1: Entwicklungsplan
Als Erstes verlangt die Norm, einen Entwicklungsplan zu erstellen. In diesem Zusammenhang sind diese Artikel lesenswert:
Kapitel 5.2: Anforderungen
Aus den Anforderungen des Produkts oder den Stakeholder-Anforderungen muss der Hersteller die Software-Anforderungen ableiten.
Kapitel 5.3 und 5.4: Architektur
In der Architektur legt der Hersteller den „Bauplan“ fest.
Kapitel 5.5 bis 5.7: Implementierung und Verifizierung
Gemäß diesem Bauplan ist dann die Software zu implementieren und zu verifizieren. Die Validierung ist nicht Gegenstand der IEC 62304, sondern der IEC 82304-1.
- Tipps zum Code Review (Kapitel 5.5)
- Anforderungen an das Testing, z. B. an
- Hinweise zu Kodierrichtlinien und zur statischen Code-Analyse z.B. zum Bestimmen der Code-Metriken wie zyklomatischen Komplexität
Kapitel 5.8: Freigabe
Die Entwicklung und Wartung schließt mit der Freigabe, die aber nicht mit der Produktfreigabe verwechselt werden darf:
Weitere Forderungen und Prozesse der Norm
3. Regulatorische Bedeutung der IEC 62304
a) Nachweis der GSPR (MDR/IVDR)
Die Medizinprodukte-Verordnungen MDR und IVDR formulieren jeweils in Anhang I die sogenannten „Allgemeinen Sicherheits- und Leistungsanforderungen“ (engl.: General Safety and Performance Requirements, GSPR).
Eine dieser Forderungen lautet, dass „bei Produkten, zu deren Bestandteilen Software gehört, oder bei Produkten in Form einer Software“ die
„Software entsprechend dem Stand der Technik entwickelt und hergestellt [wird], wobei die Grundsätze des Software-Lebenszyklus, des Risikomanagements einschließlich der Informationssicherheit, der Verifizierung und der Validierung zu berücksichtigen sind.“
Das ist eine gesetzliche Anforderung. Ein Verstoß dagegen kann mit Geld- und Freiheitsstrafen belegt werden.
Hersteller von Medizingeräten bzw. Medizinprodukten sollten die Konformität mit diesen Anforderungen nachweisen, indem sie harmonisierte Normen einhalten.
Die Norm IEC 62304 ist die speziell für die Lebenszyklus-Prozesse harmonisierte1 Norm. Eine weitere Norm ist die IEC 82304-1.
b) „Consensus Standard“ der FDA
Die FDA erkennt die IEC 62304 als „Consensus Standard“ an. Sie erwartet aber keine Konformität mit dieser Norm. Allerdings stellt die Behörde z. B. in ihren Leitlinien zur Software Validation vergleichbare Anforderungen.
c) IEC 62304 Zertifizierung
Einige Prüfstellen bieten eine „Zertifizierung nach IEC 62304“ an. Hersteller sollten sich der Grenzen dieser Zertifizierungen bewusst sein:
- Eine Zertifizierung hat keinen so hohen Wert, v. a. nicht, wenn die Prüfinstitute für diese Zertifizierung nicht akkreditiert sind. Denn solch ein Zertifikat könnte jeder ausstellen.
- Die IEC 62304 ist eine Prozessnorm, keine Produktnorm. Daher muss eine Prüfung die Prozesskonformität beurteilen und nicht das Produkt. Das Zertifikat sagt also nicht direkt etwas über die Produktgüte aus.
- Die Behauptung einiger Prüfstellen, dass die Zertifizierung dabei helfe, beim Testen Zeit zu sparen, ist nicht nachvollziehbar. Hersteller können durch Testautomatisierung sowie durch den Einsatz von geeigneten Werkzeugen und Verfahren Zeit sparen. Die Zertifizierung senkt den Testaufwand aber nicht.
- Im Rahmen einer Zertifizierung nach ISO 13485, die von akkreditierten Stellen vorgenommen wird, müssen Auditoren ohnehin indirekt die Konformität mit IEC 62304 prüfen, zumindest exemplarisch.
Das Johner Institut rät nicht generell von einer Zertifizierung nach IEC 62304 ab. Aber jeder sollte die „Beweiskraft“ dieser Zertifikate kennen.
4. Unterstützung bei der IEC 62304
Nutzen Sie die Unterstützung des Johner Instituts:
- Der Auditgarant zeigt Ihnen anhand von Videotrainings, wie Sie Schritt für Schritt eine schlanke und IEC-62304-konforme Dokumentation erstellen. Ein vollständiger Satz an Templates nimmt Ihnen viel Arbeit ab.
Melden Sie sich gleich, damit wir gemeinsam die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Produkte schnell in den Markt kommen.