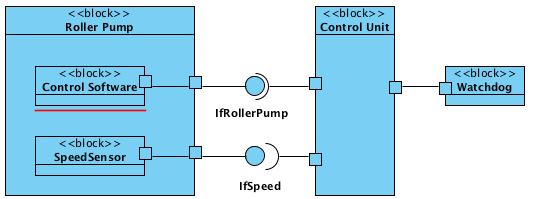
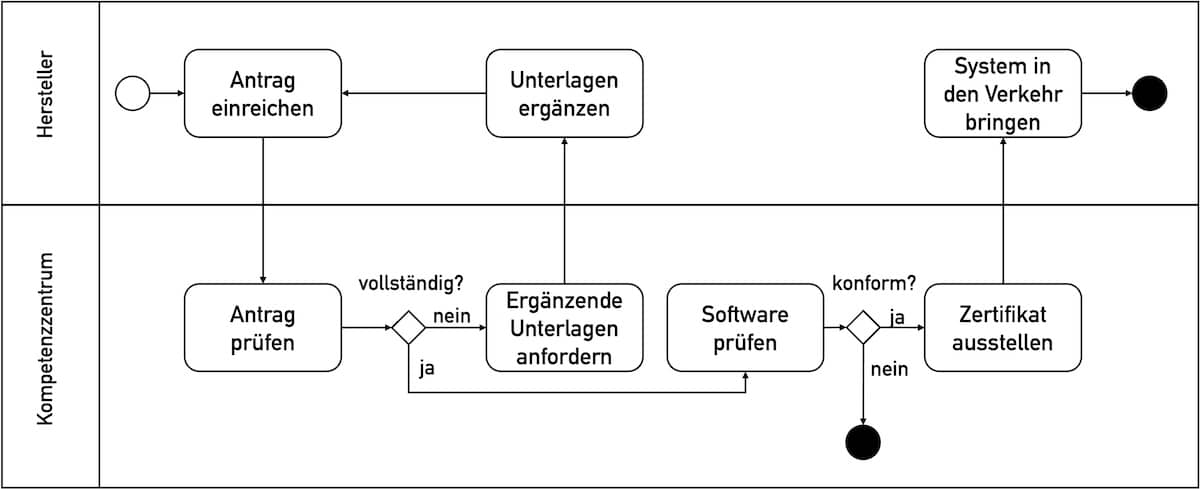
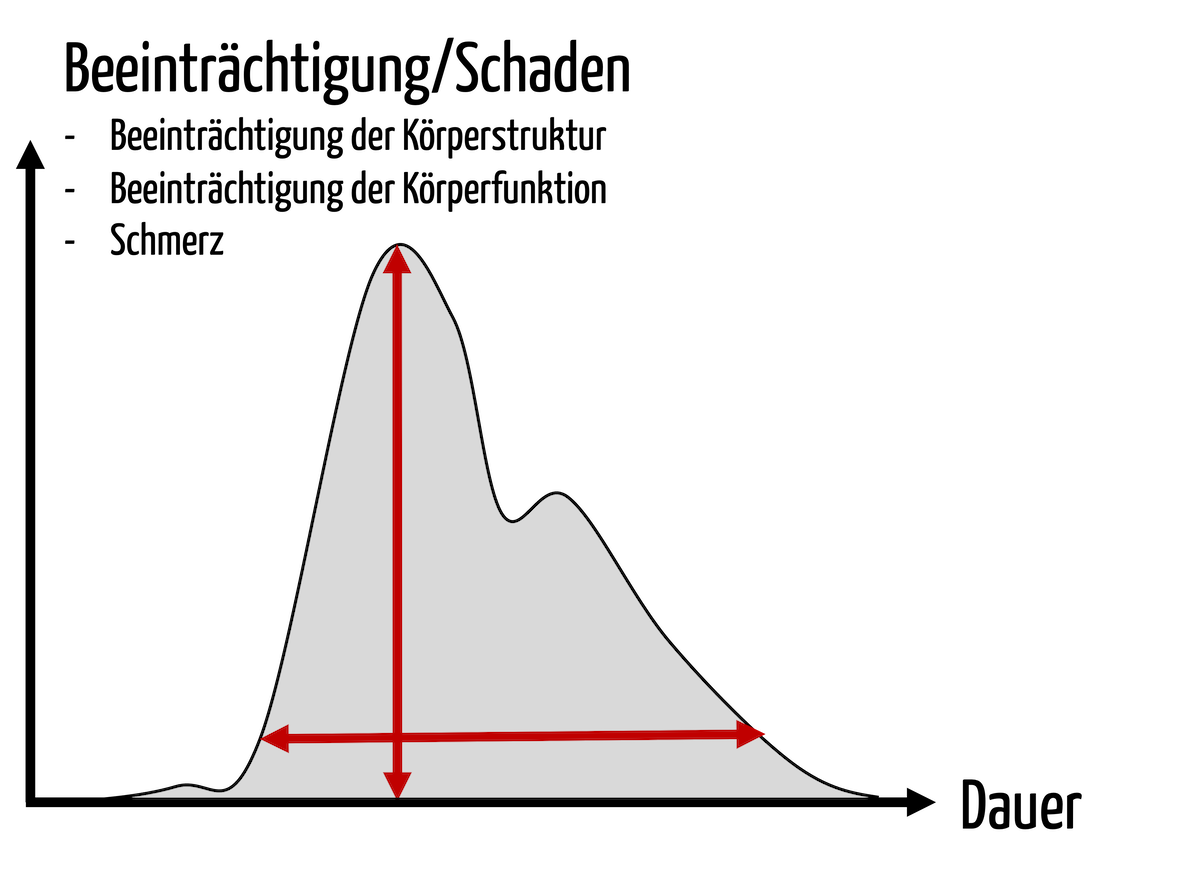
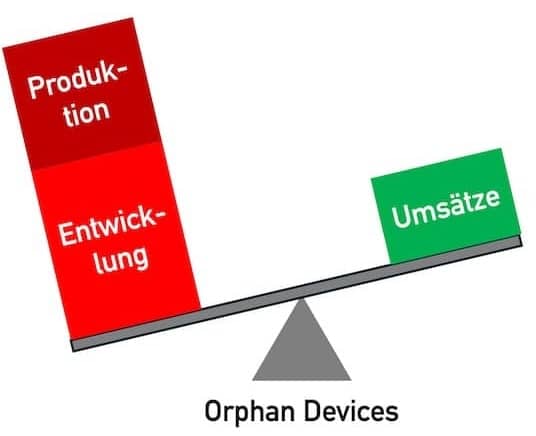
Übergangsfristen der MDR
Die MDR legt in den Artikeln 120 bis 123 die Übergangsbestimmungen einschließlich der Übergangsfristen fest. Allerdings sind diese Übergangsbestimmungen und Übergangsfristen sehr komplex formuliert. Daher laufen die Hersteller Gefahr, sie falsch zu verstehen und regulatorische Anforderungen nicht zu erfüllen oder unnötige Aufwände zu betreiben. Ein Ablaufdiagramm in Kapitel 2 dieses Artikels fasst die regulatorischen Anforderungen…
Details