Software-Wartung: Wie Sie typische Fallen im Audit vermeiden
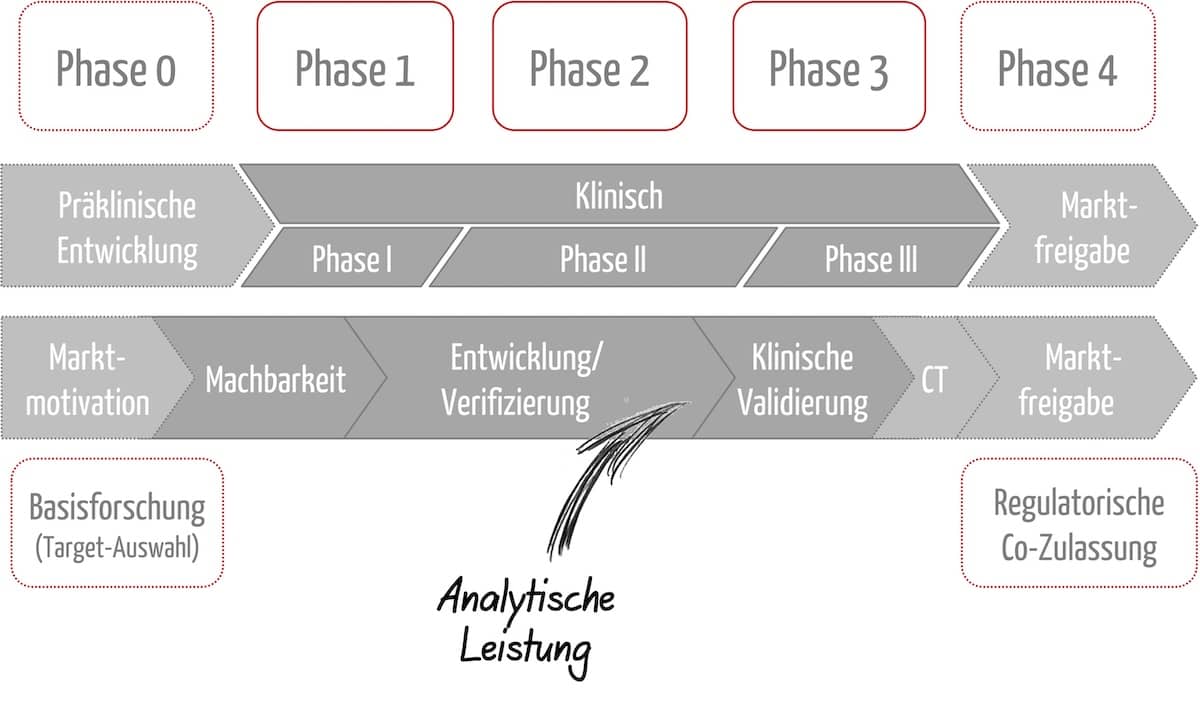
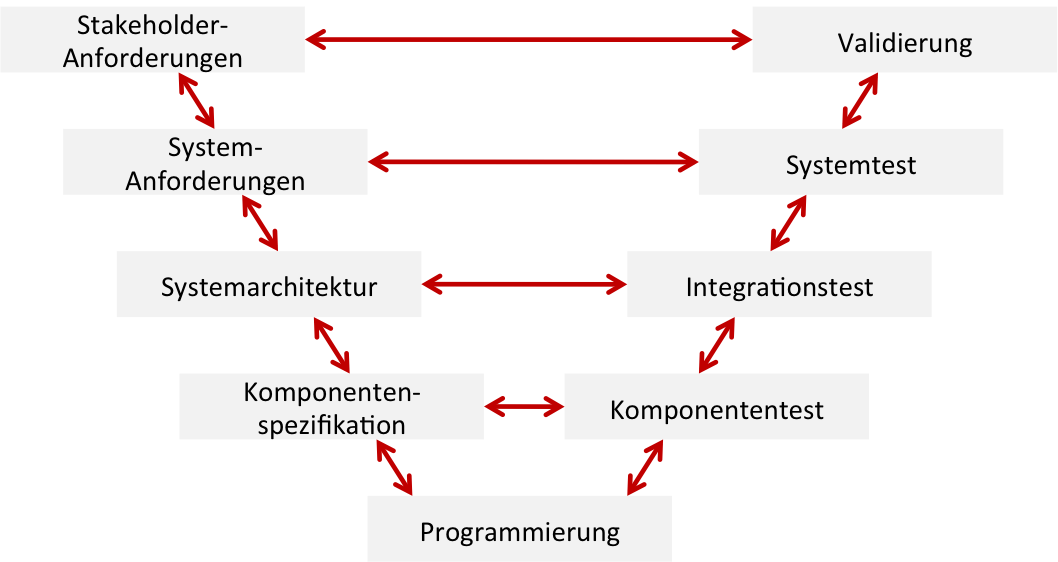
Unter Software-Wartung versteht man die Phase, in der die Software weiterentwickelt wird, z. B. mit dem Ziel 79% aller Bugs werden laut FDA während der Software-Wartung eingeführt. Entsprechend adressieren einige Regularien dieses Thema. Update: Ergänzung zur Software-Wartung während der Entwicklung
Details