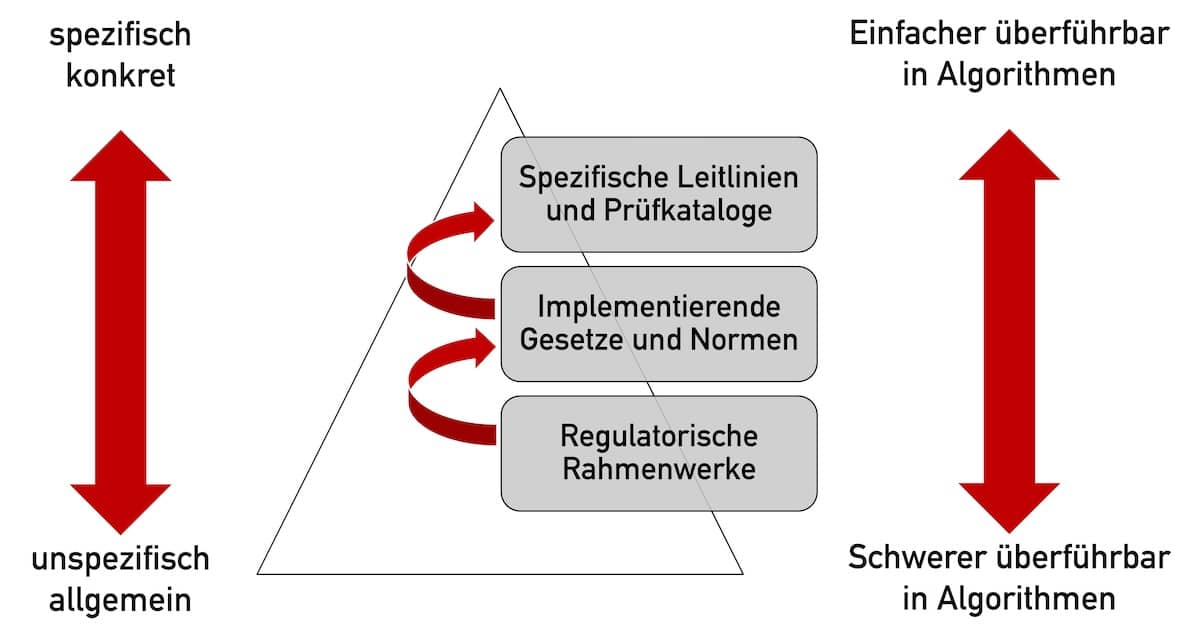
PMS-Daten: Müssen Sie beim Sammeln eine Ethik-Kommission einbeziehen?
Die MDR verpflichtet die Hersteller von Medizinprodukten zur Post-Market Surveillance (PMS) und damit zum Sammeln von PMS-Daten. Dieser Artikel soll zur Klärung beitragen, welche regulatorischen Anforderungen Hersteller beim Sammeln dieser PMS-Daten beachten müssen. Insbesondere soll er aufzeigen, ob Hersteller eine Ethik-Kommission einbeziehen müssen, wenn die Daten bei der Routine-Anwendung der Produkte anfallen.