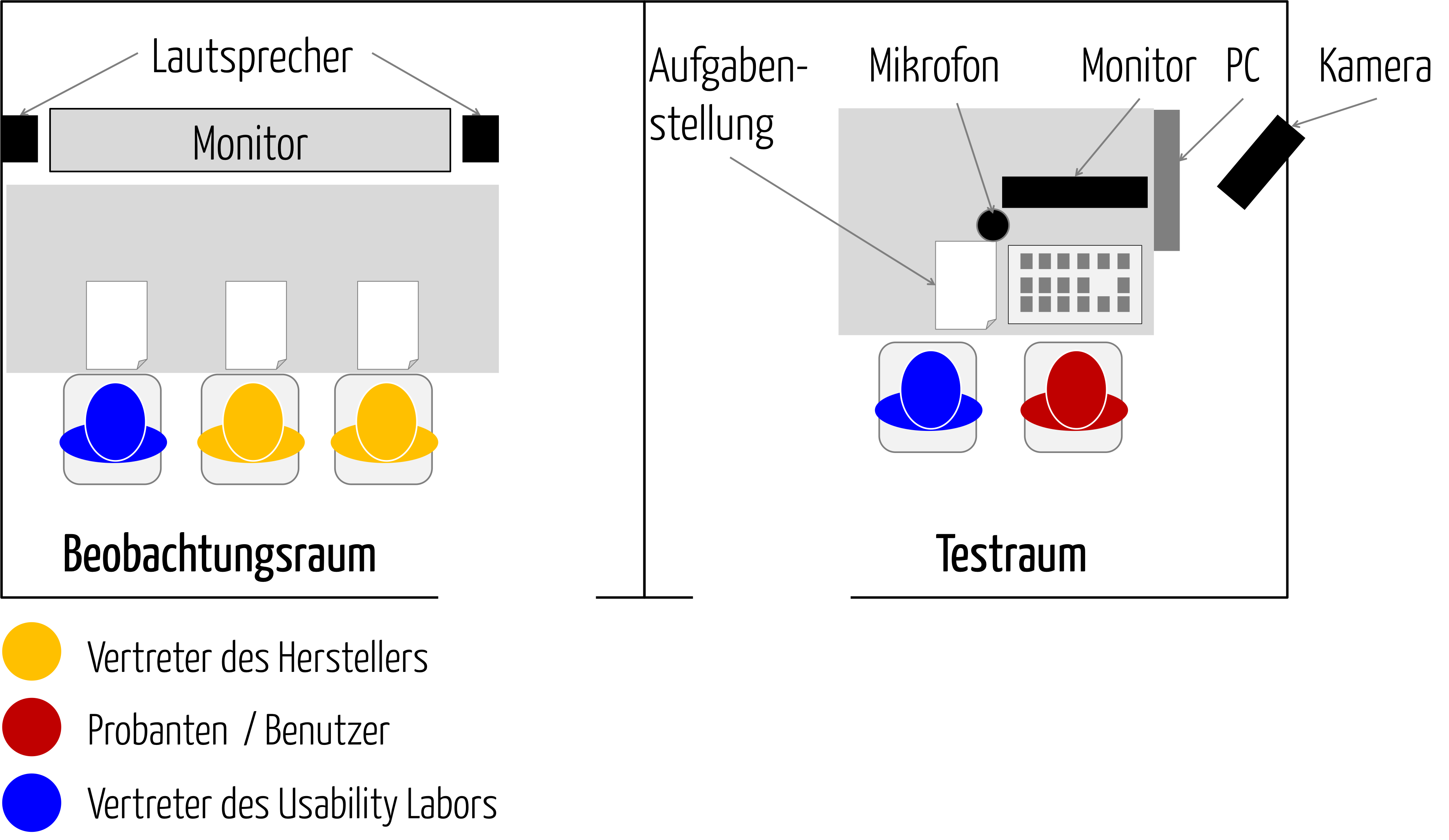
Usability Lab: Worauf Sie bei der Auswahl achten sollten
Ein Usability Lab ist eine Einrichtung, in der Usability-Experten Gebrauchsumgebungen simulieren können, um die Gebrauchstauglichkeit (Usability) von Produkten mit Usability-Tests zu überprüfen. Dazu lassen sie Testpersonen (Probanden) Aufgaben mit diesen Produkten lösen. In diesem Beitrag erfahren Sie,
Weiterlesen