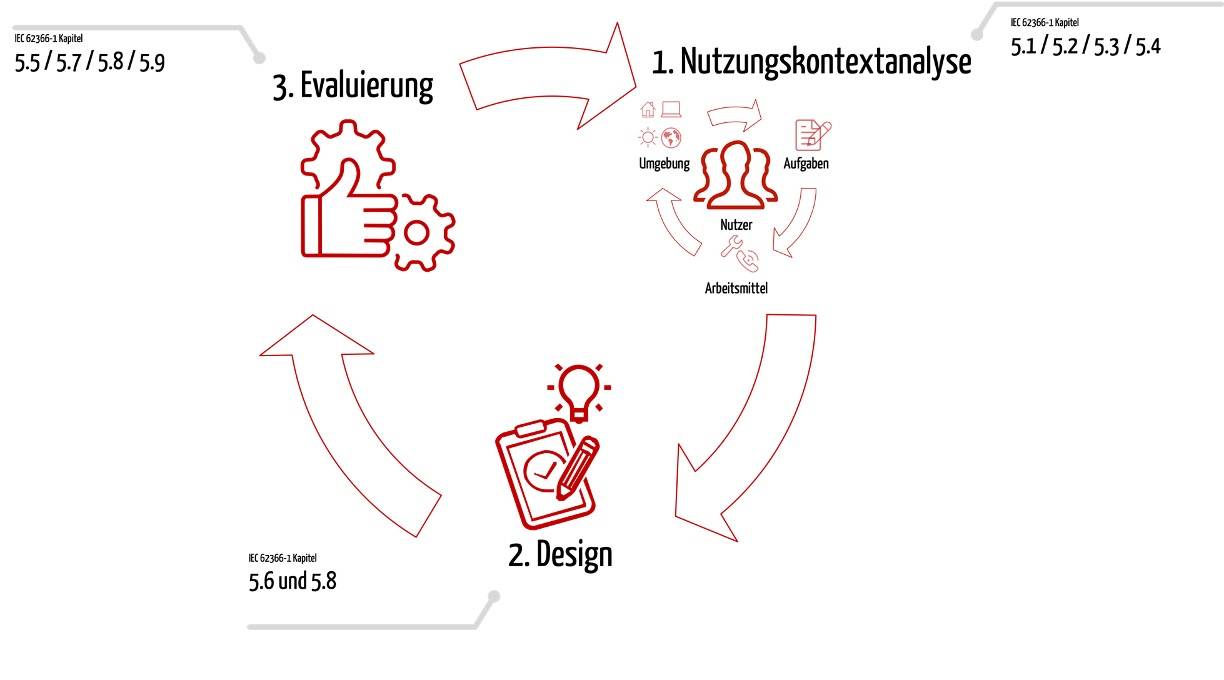
Klinische Bewertung von Software: Drei Beweise für die Konformität
Für die klinische Bewertung von Software gelten die gleichen gesetzlichen Anforderungen wie für die klinische Bewertung aller Medizinprodukte. Das heißt, als Hersteller von Medical Device Software (MDSW) müssen Sie genau wie alle anderen Hersteller eine klinische Bewertung für Ihr Produkt erstellen. Für Software, die ein In-vitro-Diagnostikum (IVD) darstellt, muss eine Leistungsbewertung durchgeführt werden. Das wiederum…
Details