MPBetreibV – Medizinprodukte-Betreiberverordnung
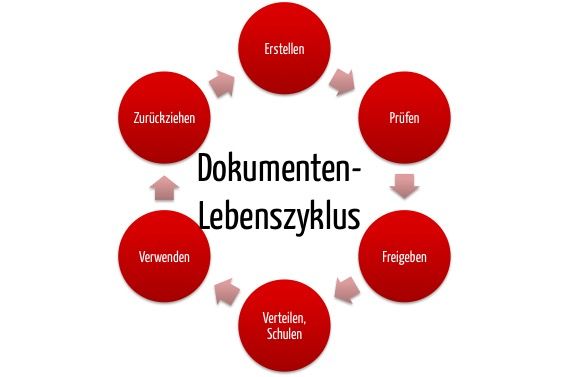
Die Medizinprodukte-Betreiberverordnung (MPBetreibV) ist eine nationale deutsche Verordnung, die Anforderungen an das Erstellen, Betreiben und Anwenden von Medizinprodukten stellt. In einigen Fällen werden auch Hersteller zu Betreibern und unterliegen damit der MPBetreibV.
Weiterlesen