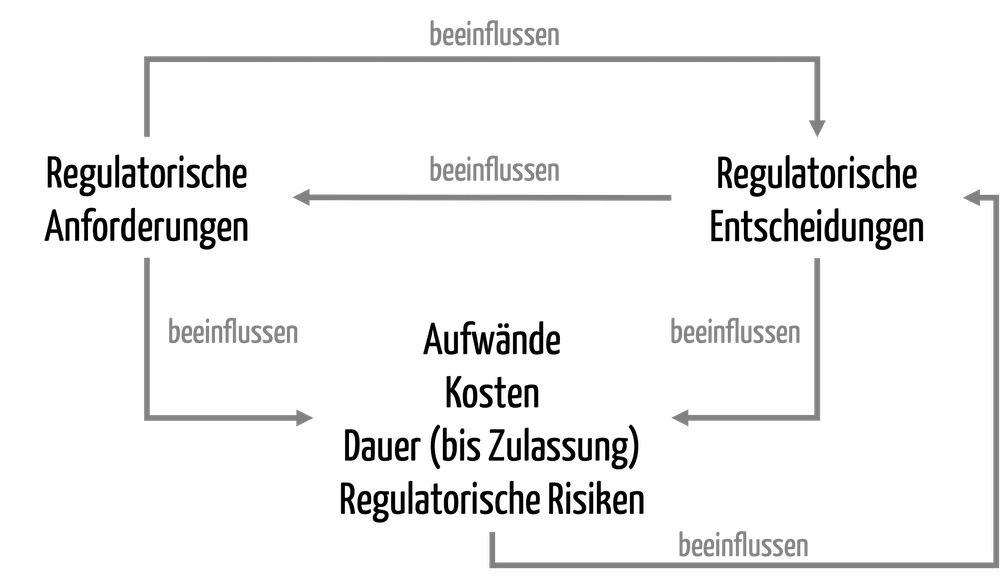
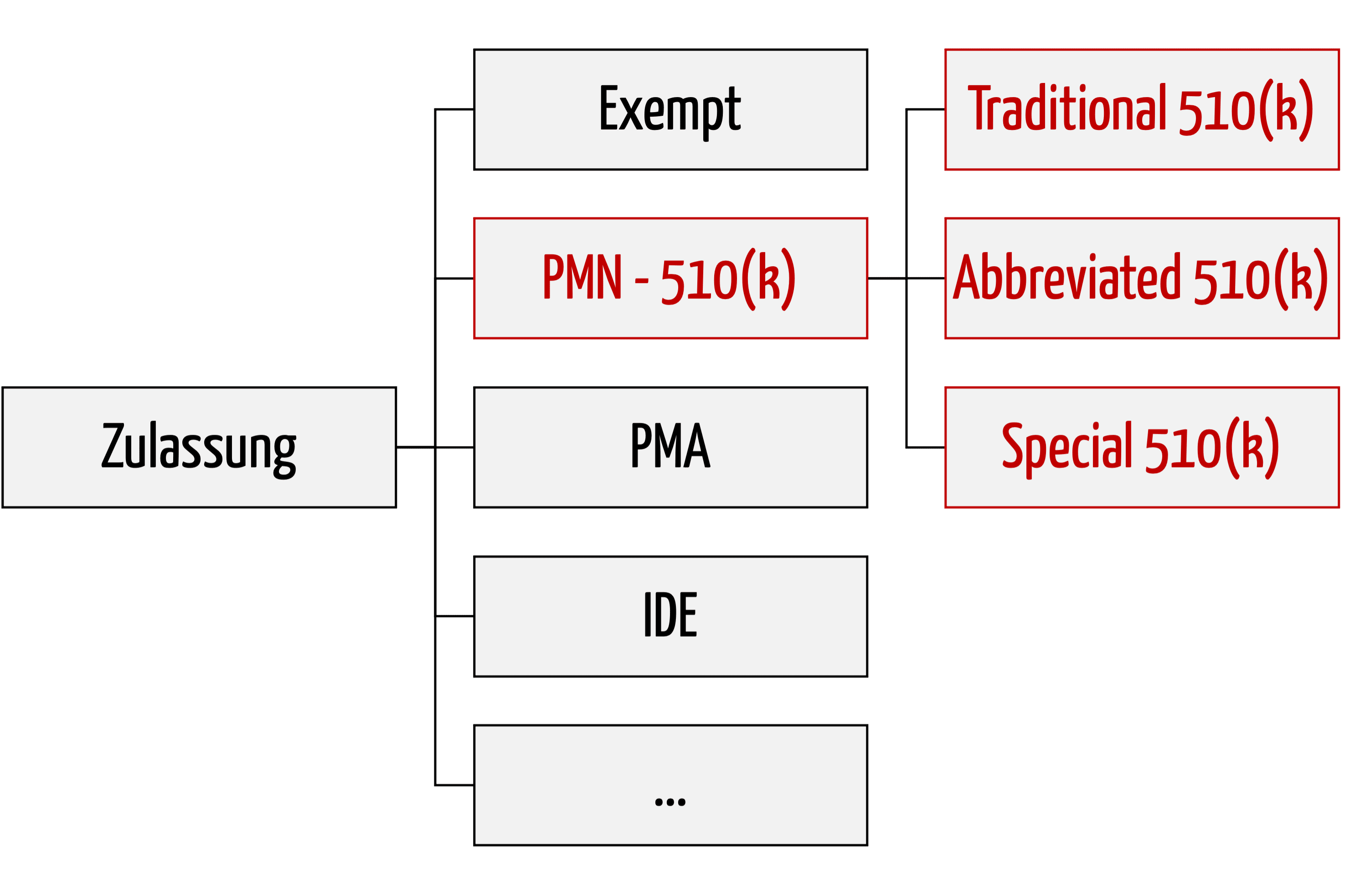
Digitalisierung der Produktion
Die Digitalisierung der Produktion ist ein wesentlicher Bestandteil der digitalen Transformation von produzierenden Unternehmen. Doch nicht alle Unternehmen profitieren im gleichen Maß von Digitalisierungsmaßnahmen. Dieser Artikel beschreibt,
Details