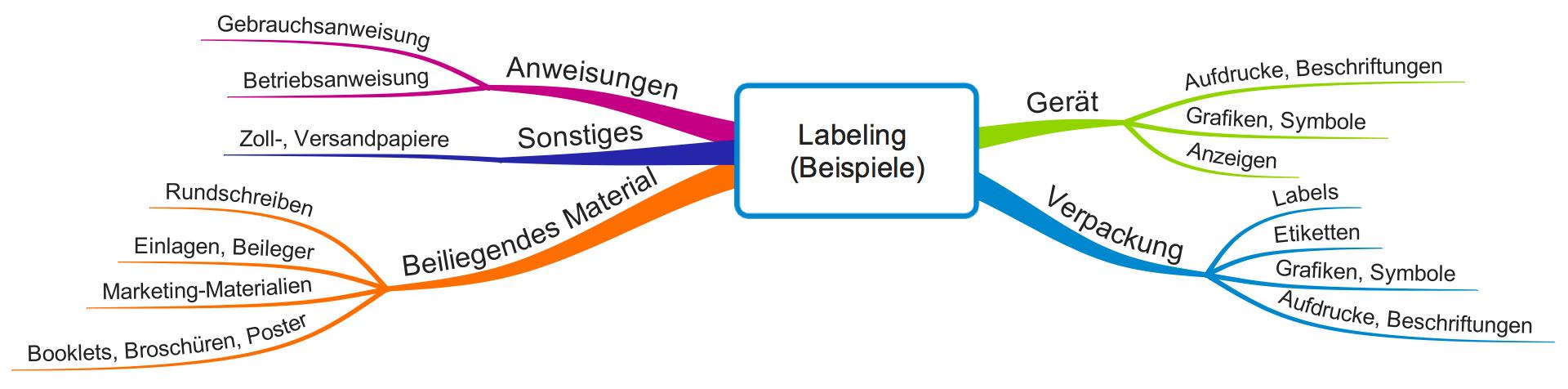
Gebrauchstauglichkeitsakte: Konformitätsnachweis mit IEC 62366-1 und FDA
Die Gebrauchstauglichkeitsakte ist die Sammlung aller Dokumente, mit denen Sie den Nachweis erbringen, dass Sie die gesetzlichen Anforderungen an die Gebrauchstauglichkeit Ihres Medizinprodukts nachweisen. Dieser Artikel