Audit-Trail: Was Sie als Medizinproduktehersteller wissen sollten
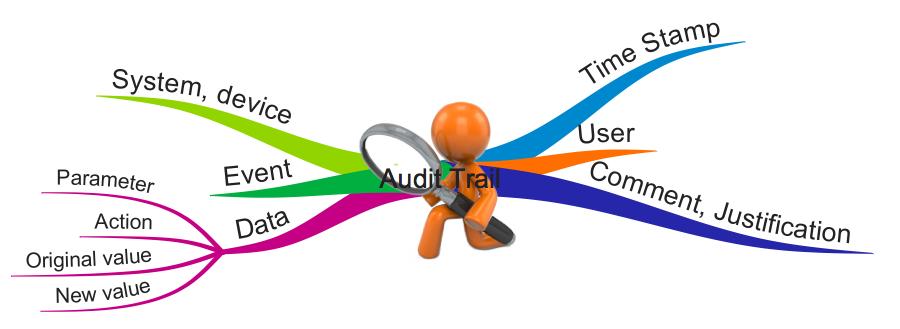
Viele Hersteller erstellen mit ihren Produkten sogenannte Audit-Trails, auch Audit-Logs genannt. Teilweise sind die Hersteller dazu verpflichtet, teilweise schränken Gesetze diese Audit-Trails ein. Dieser Artikel fasst zusammen, worauf insbesondere Medizinproduktehersteller achten sollten, wenn sie mit Audit-Trails arbeiten. Anmerkung: Dieser Artikel verwendet die Begriffe „Audit-Trail“ und „Audit-Log“ synonym.
Details