EU-Batterieverordnung: Was Medizinproduktehersteller wissen müssen
Die EU plant, mit der neuen EU-Verordnung zu Batterien und Altbatterien („Batterieverordnung“) die EU die bestehende Richtlinie 2006/66/EG zu ersetzen. Dieser Artikel klärt darüber auf,
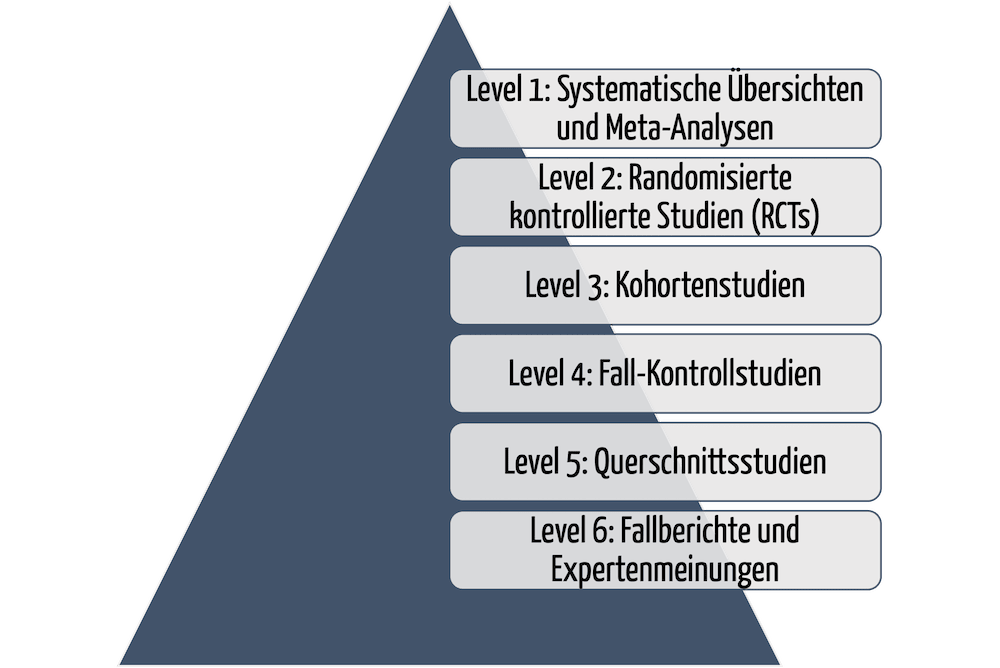
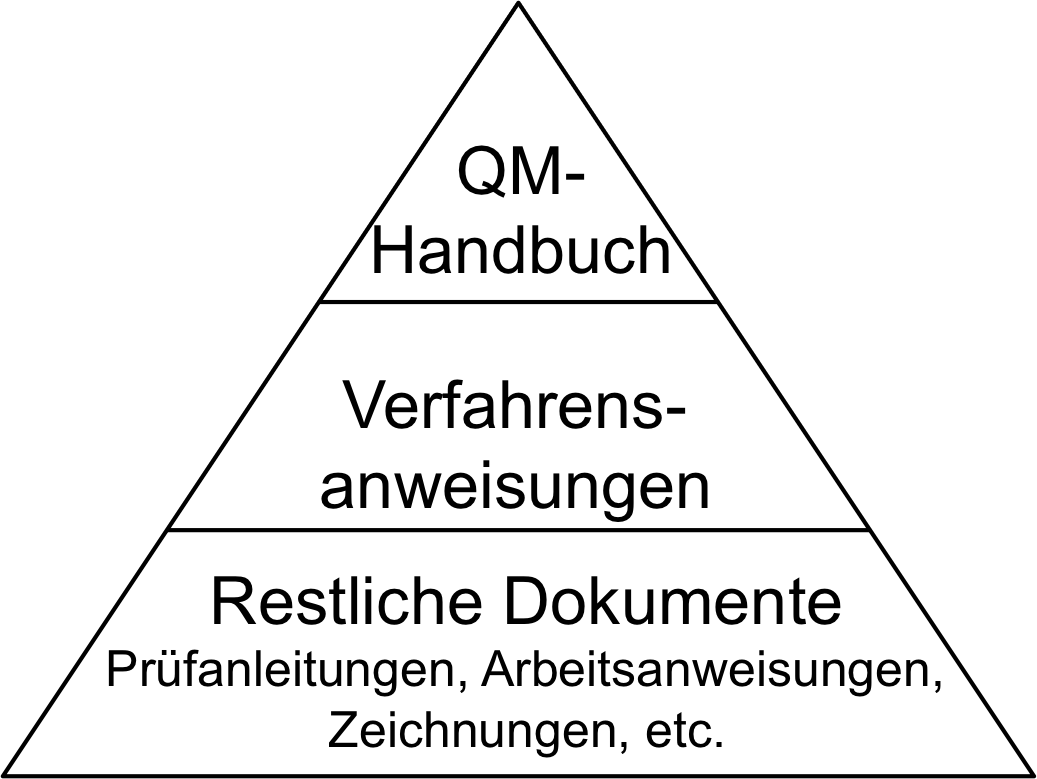
Details