Entwicklungsprozess für Medizinprodukte: Schlank und normenkonform
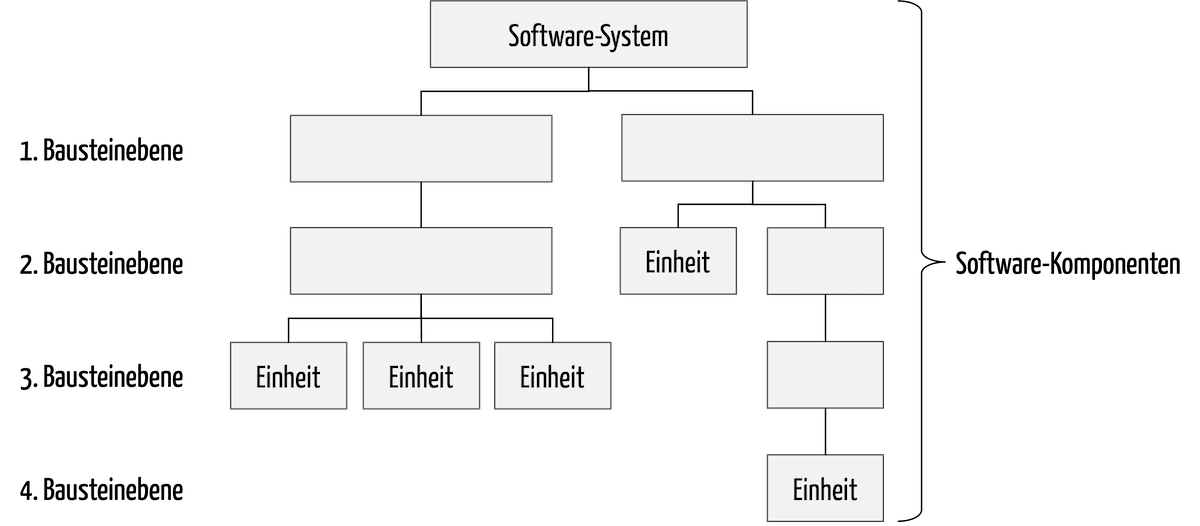
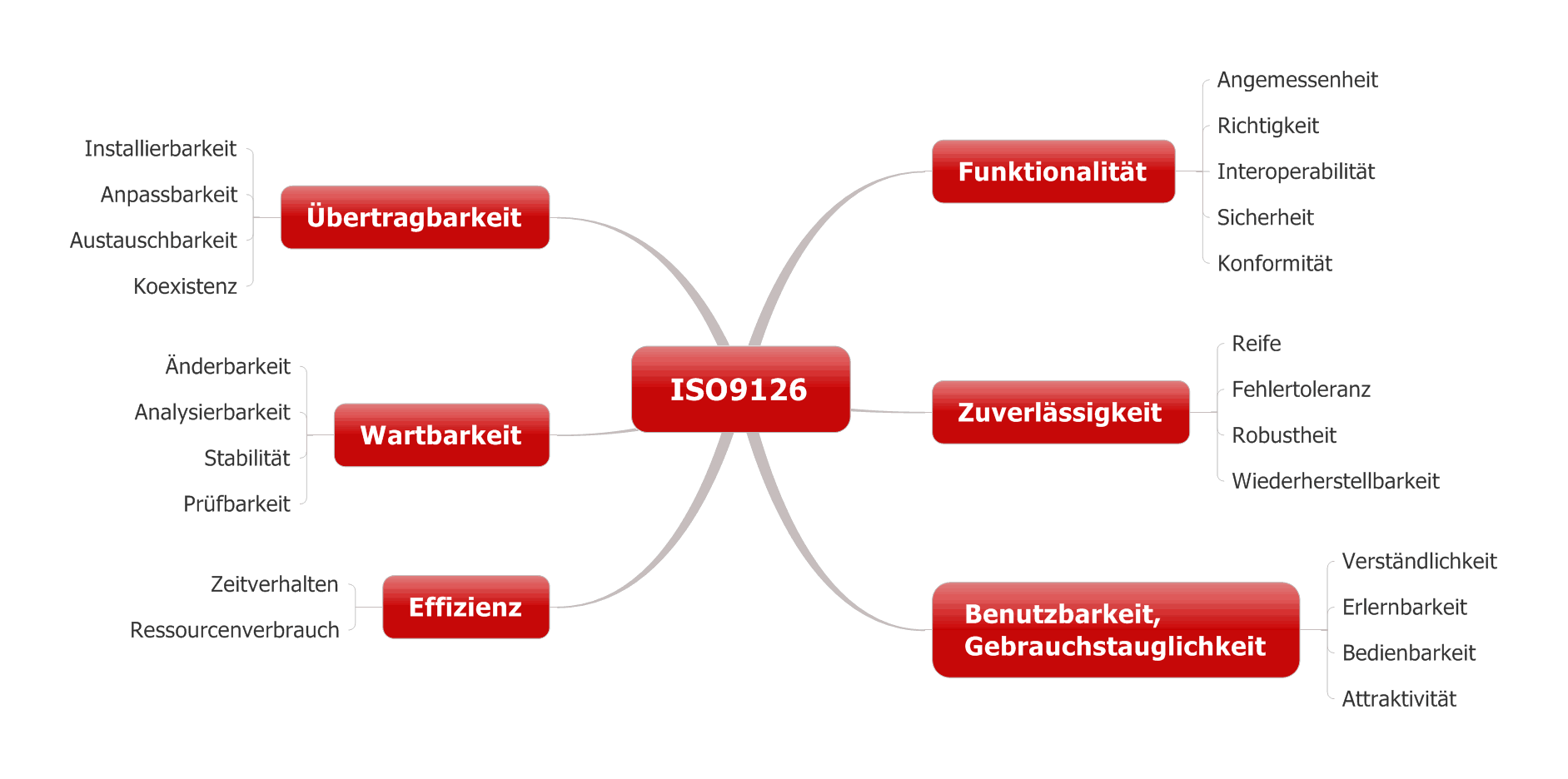
Gesetze und Normen formulieren Anforderungen, wie Medizinproduktehersteller den Entwicklungsprozess festlegen und dokumentieren müssen. Diese Anforderungen prüfen Benannte Stellen bei Audits. Dieser Artikel zum Entwicklungsprozess gibt Ihnen Tipps zu dessen Gestaltung und zum Abgleich mit anderen Prozessen wie dem Risikomanagementprozess.
Details