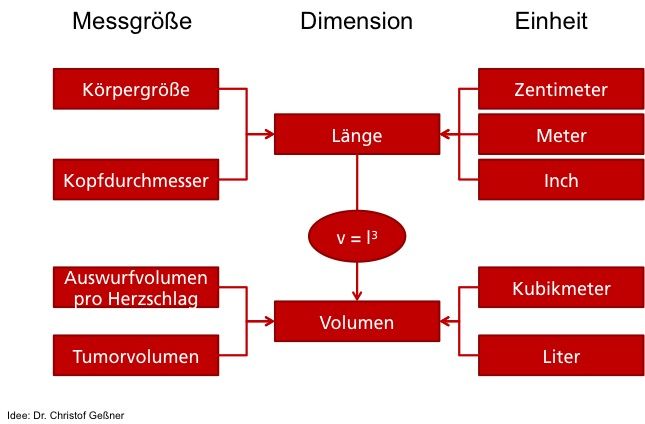
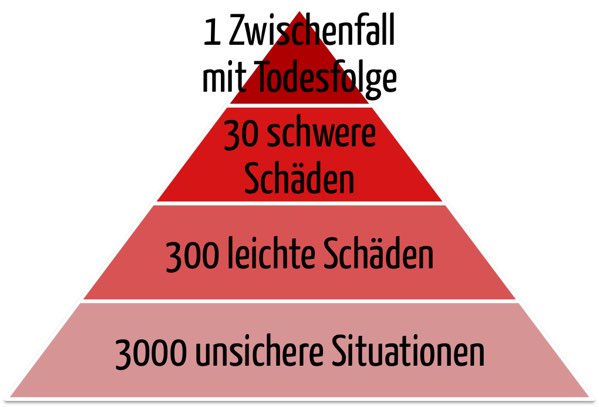
ISO 19011: Wie Sie (interne) Audits richtig planen und durchführen
Die ISO 19011 kennen leider nur wenige Medizinproduktehersteller. Dabei gibt ihnen diese Norm konkrete Hinweise, wie man Audits systematisch plant, durchführt, dokumentiert und nachbereitet. Ihre benannten Stellen haben die ISO 19011 im Hinterkopf, wenn Sie bei Ihnen im ISO 13485-Zertifzierungsaudit prüfen, ob Sie interne Audits wirksam durchführen. Ein Grund mehr, diese ISO 19011 kennen zu…
Weiterlesen