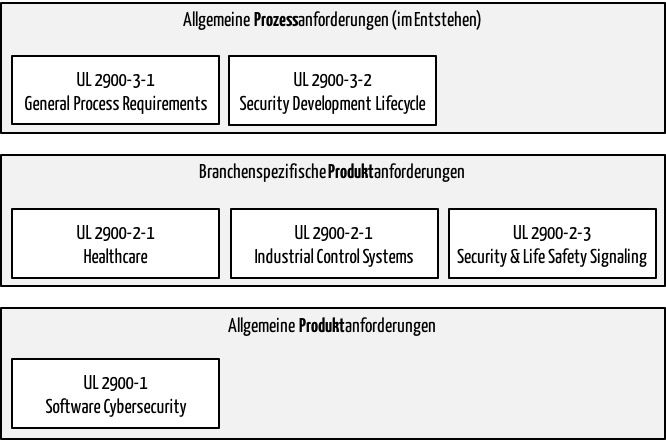
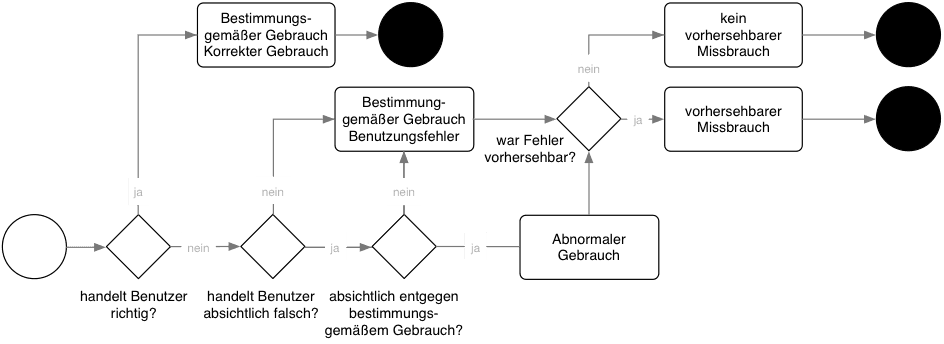
Fuzz-Testing: IT-Sicherheit von Produkten bewerten
Fuzz-Testing ist eine Methode zur Identifizierung bisher nicht-erkannter Schwachstellen und Sicherheitslücken in Software (stand-alone oder embedded), die die Schnittstellen der Systeme automatisiert mit korrekten oder falschen Werten testet.