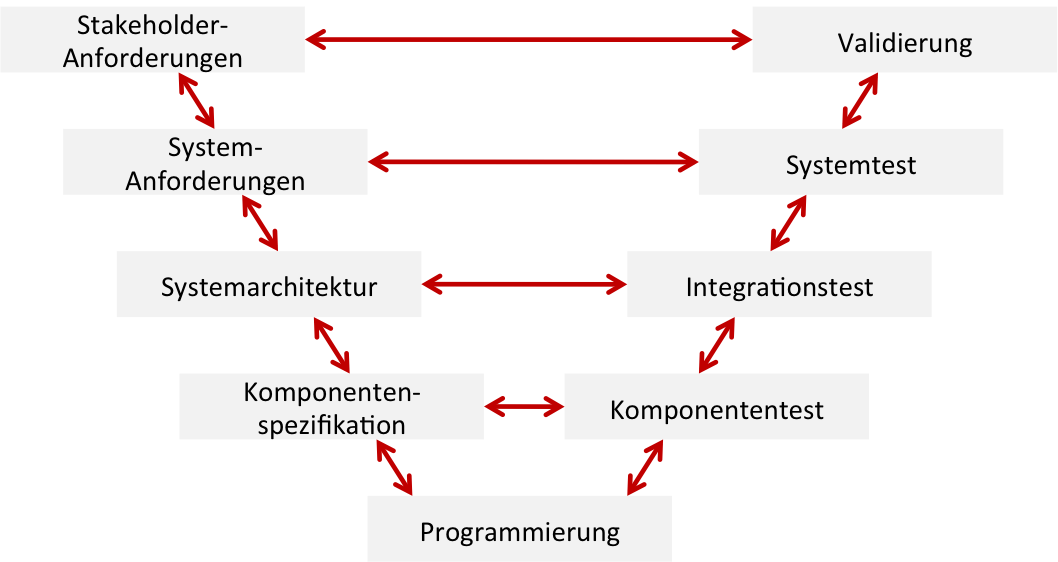
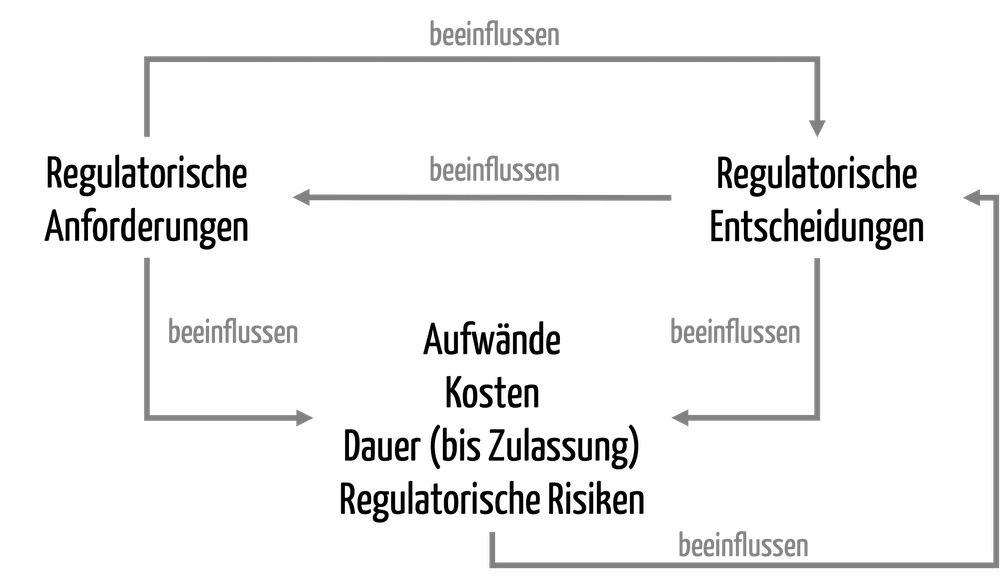
Traceability: Drei Kontexte unterscheiden!
Der Begriff Tracebility (auf deutsch Nachverfolgbarkeit) wird im Kontext von Medizinprodukten in verschiedenen Kontexten unterschiedlich verstanden. Entsprechend unterschiedlich sind auch die regulatorischen Anforderungen, welche die Hersteller und anderen Akteure (z.B. Betreiber, Lieferanten) erfüllen müssen. Sowohl mit dem Verständnis des Konzepts als auch mit dem Erfüllen der regulatorischen Anforderungen tun sich viele Organisationen schwer. Dieser Artikel…
Weiterlesen