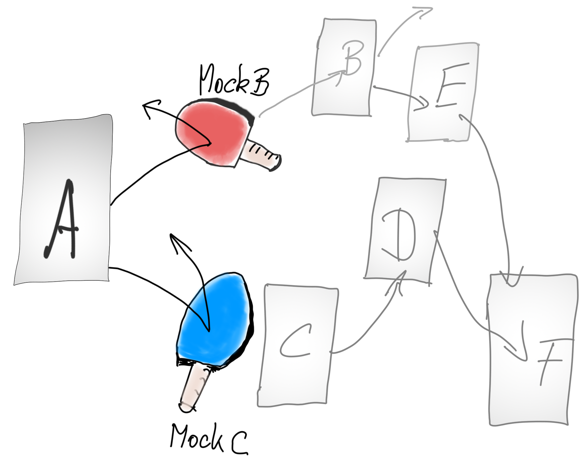
Mock-Objekt beim Testen von medizinischer Software
Ein Mock-Objekt hilft beim Integrationstest, Teile eines Software-Systems zu ersetzen bzw. zu simulieren, solange bis diese Teile schrittweise dem System hinzugefügt werden. Lesen Sie in diesem Artikel, wie sich Mocks von Dummies und Stubs unterscheiden und ob Sie ein Mock-Objekt auch verifizieren müssen.
Details