In-vitro-Diagnostika (IVD) sind eine Untergruppe der Medizinprodukte. IVD gewinnen medizinische Informationen aus menschlichen Proben. Ihr klinischer Nutzen liegt in der Bereitstellung von präzisen, genauen und richtigen Informationen.
Inhalt
Diese Seite verschafft Ihnen einen schnellen Überblick über die gesetzlichen Anforderungen an In-vitro Diagnostika:
- Definition eines In-vitro Diagnostikums
- Regulatorische Anforderungen an IVD
- Besondere Anforderungen an spezielle IVD
- Unterstützung für IVD-Hersteller und Labore
1. Definition IVD
a) Definition in Europa
Die EU-Verordnung 2017/746 über In-vitro-Diagnostika (IVDR) definiert, was ein In-vitro Diagnostikum ist:
Definition: In-vitro-Diagnostikum
bezeichnet ein Medizinprodukt, das als Reagenz, Reagenzprodukt, Kalibrator, Kontrollmaterial, Kit, Instrument, Apparat, Gerät, Software oder System — einzeln oder in Verbindung miteinander — vom Hersteller zur In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben, einschließlich Blut- und Gewebespenden, bestimmt ist und ausschließlich oder hauptsächlich dazu dient, Informationen zu einem oder mehreren der folgenden Punkte zu liefern
- über physiologische oder pathologische Prozesse oder Zustände,
- über kongenitale körperliche oder geistige Beeinträchtigungen,
- über die Prädisposition für einen bestimmten gesundheitlichen Zustand oder eine bestimmte Krankheit,
- zur Feststellung der Unbedenklichkeit und Verträglichkeit bei den potenziellen Empfängern,
- über die voraussichtliche Wirkung einer Behandlung oder die voraussichtlichen Reaktionen darauf oder
- zur Festlegung oder Überwachung therapeutischer Maßnahmen.
Probenbehältnisse gelten als auch In-vitro-Diagnostika.
b) Definition der FDA
Ähnlich lautet die Definition der FDA:
Definition: In vitro diagnostic product
In vitro diagnostic products are those reagents, instruments, and systems intended for use in diagnosis of disease or other conditions, including a determination of the state of health, in order to cure, mitigate, treat, or prevent disease or its sequelae. Such products are intended for use in the collection, preparation, and examination of specimens taken from the human body.
2. Regulatorische Anforderungen an IVD
a) Gesetzliche Rahmenwerke
In Europa müssen Hersteller, Importeure und Händler von In-vitro Diagnostika die IVDR einhalten. Sie sollten die Unterschiede zwischen der IVDR und IVDD kennen.
Je nach Produktart sind für ein IVD ggf. weitere EU-Verordnungen, Gemeinsame Spezifikationen oder EU-Richtlinien (z. B. die Maschinenrichtlinie) relevant.
Die FDA stellt eigene Anforderungen an die Inverkehrbringung von IVDs.
b) Zulassung
Für die Zulassung von In-vitro Diagnostika verschaffen die folgenden Fachartikel das notwendige Expertenwissen:
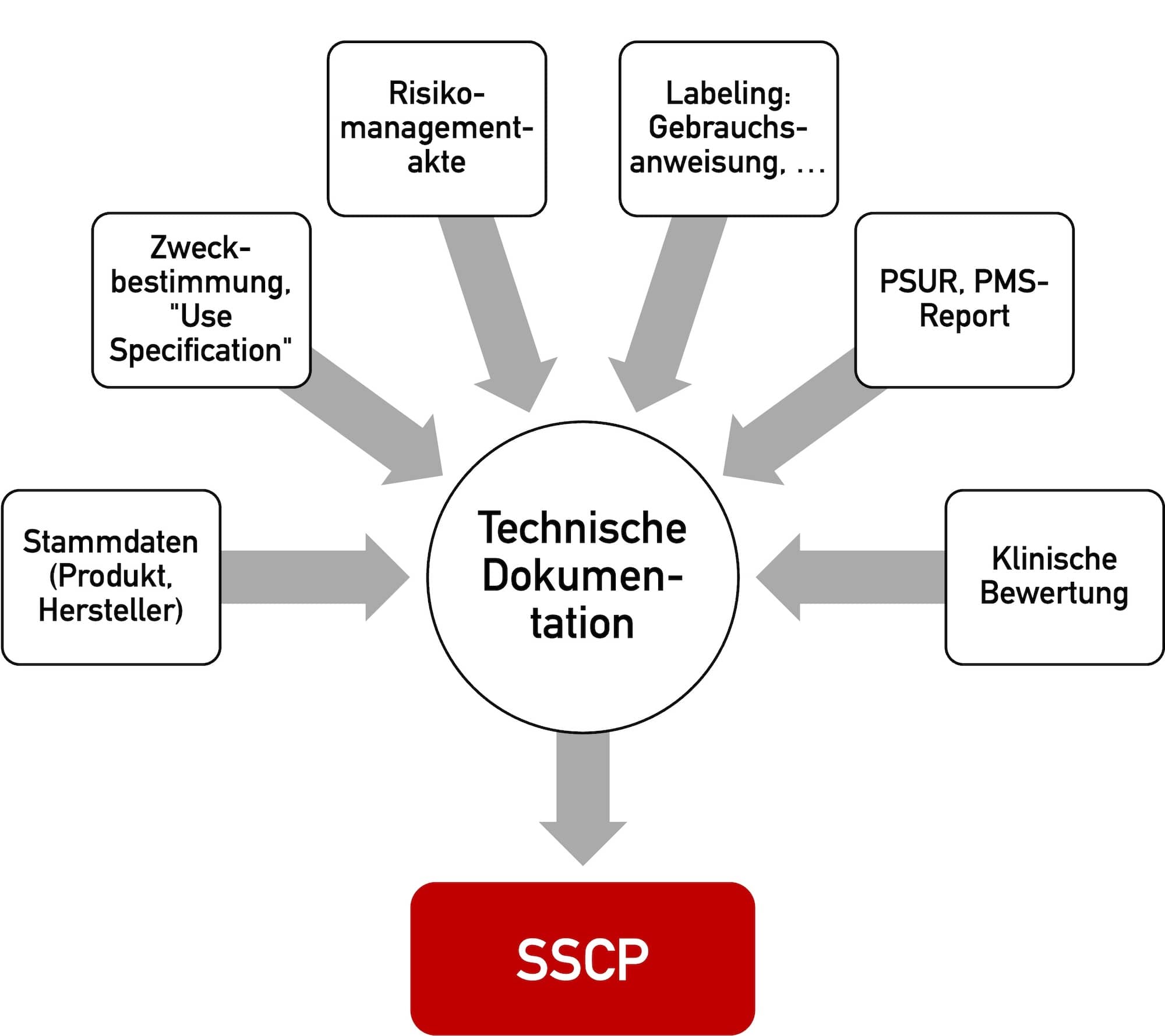
c) Nachzuweisende Anforderungen
Um IVD in Europa und anderen Märkten in den Markt bringen zu dürfen, müssen diese Produkte Anforderungen erfüllen. Dazu zählen u. a. die grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I der IVDR, sowie Anforderungen an
d) Weitere Anforderungen
Zudem müssen die Hersteller dafür sorgen, dass sie z. B.
3. Besondere Anforderungen an spezielle IVD
Spezielle IVD müssen besondere Anforderungen erfüllen. Eine Übersicht geben Ihnen diese Artikel:
Wenn die Produkte Software enthalten bzw. als IVD-Software qualifizieren, sind die folgenden Artikel hilfreich:
Beachten Sie auch die Artikel für Gesundheitsdienstleister wie medizinische Labore z.B. den Artikel zu den Good Laboratory Practices.
4. Unterstützung für IVD-Hersteller und medizinische Labore
a) Kostenfreie Angebote
Haben Sie noch Fragen zu In-vitro Diagnostika und den regulatorischen Anforderungen? Antworten bekommen Sie im kostenlosen Micro-Consulting.
Laden Sie sich das kostenlose Starter-Kit herunter, das Ihnen einen Überblick über die regulatorische Landschaft verschafft und Ihnen die Schritte zur „Zulassung“ Ihres IVDs aufzeigt. Es enthält auch die IVDR-Checkliste im PDF- und im DOCX-Format!
b) Videos und E-Learning
Die Videotrainings im Auditgarant zeigen Ihnen Schritt für Schritt, wie Sie Ihre Technische Dokumentation und Ihr QM-System ebenso schlank wie schnell und IVDR-konform erstellen. Dazu stehen Ihnen über 100 Templates und Musterdokumente zum Download bereit.
Damit schaffen Sie Voraussetzungen, um Ihre Produkte schnell und sicher zuzulassen und in den Markt zu bringen.
c) Seminare
Speziell an IVD-Hersteller und Labore wenden sich die Seminare:
d) Prüfung
Die Experten des Johner Instituts helfen Ihnen beim Prüfen Ihrer Produkte:
e) Beratung und Unterstützung
Die Experten des Johner Instituts helfen Ihnen dabei, Ihre Produkte regulatorisch konform zu entwickeln und auf den Markt zu bringen. Dabei stehen wir Ihnen entweder hilfreich zur Seite oder übernehmen auch einen Teil der Arbeit.
Nutzen Sie die Regulatory Affairs Experten, um Ihre
Nehmen Sie gleich Kontakt auf, damit wir gemeinsam klären können, wie Sie die regulatorischen Anforderungen der IVDR schnell und einfach erfüllen und Ihre Produkte sicher in den Markt bekommen.
Kontakt aufnehmen