Lieferantenbewertung – Lieferantenauswahl – Lieferantenaudit
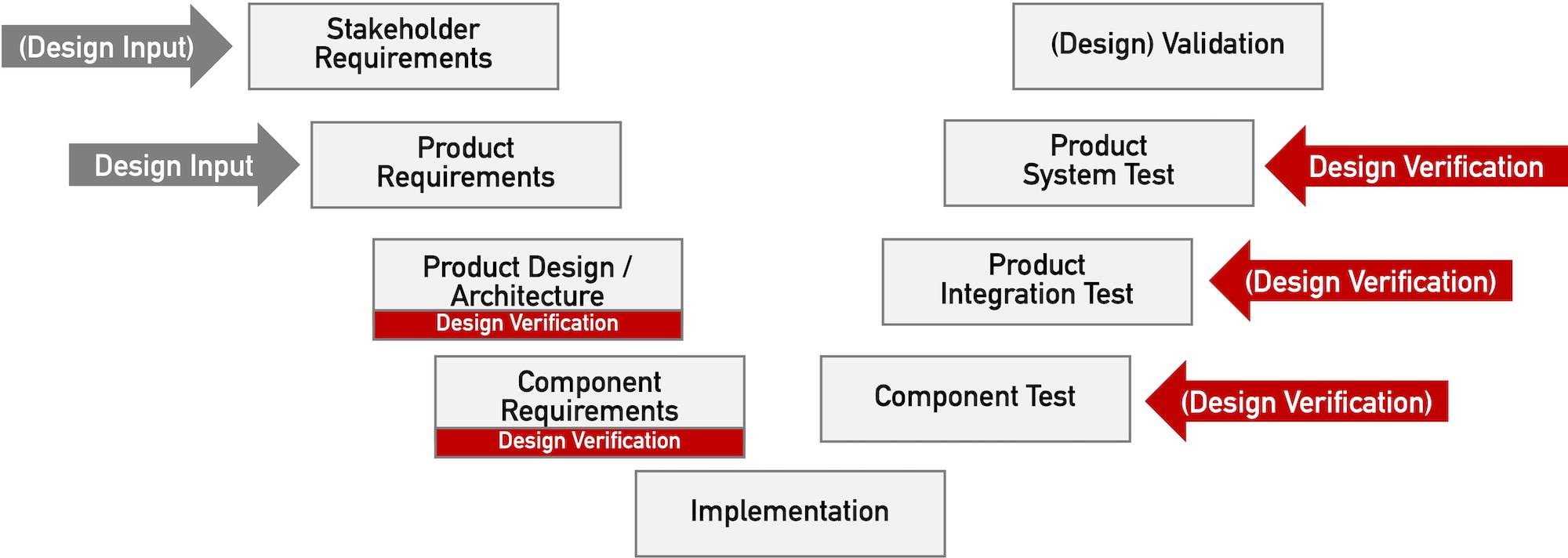
MDR und IVDR sowie die ISO 13485:2016 formulieren ebenso wie die FDA klare Anforderungen an die Lieferantenbewertung, Lieferantenauswahl und Lieferantenüberwachung. Dieser Artikel verschafft Ihnen einen Überblick über die regulatorischen Anforderungen an das Lieferantenmanagement. Er gibt zudem Tipps zur praxisnahen Umsetzung und verrät, wann ein Lieferantenaudit notwendig ist.
Details