FDA: Interoperability Guidance (1. Entwurf)
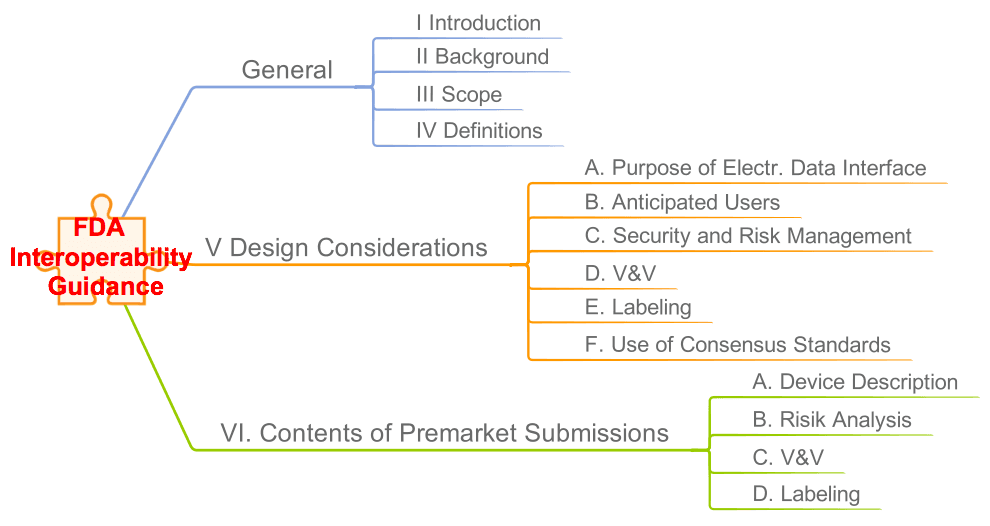
Die FDA hat ein Interoperability Guidance als Entwurf veröffentlicht. Es trägt den Titel „Design Considerations and Pre-market Submission Recommendations for Interoperable Medical Devices“ (hier zum Download). Lesen Sie hier, was die FDA damit bezweckt und auf welche Anforderungen Sie sich einstellen müssen.
Details