Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
e) Regulatorische Rollen
Sie finden hier Fachartikel zu mehreren regulatorischen Rollen;
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
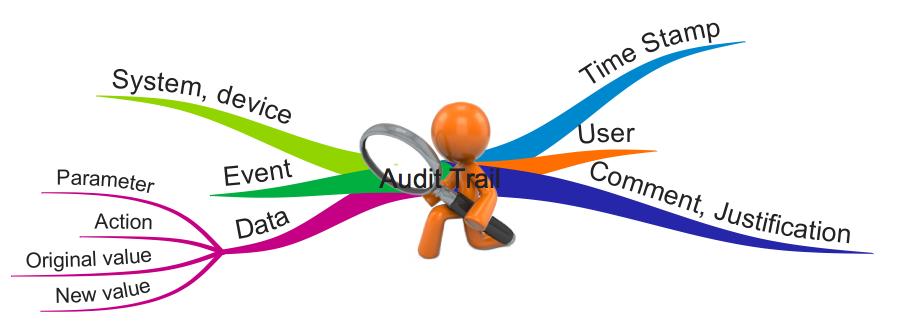
Viele Hersteller erstellen mit ihren Produkten sogenannte Audit-Trails, auch Audit-Logs genannt. Teilweise sind die Hersteller dazu verpflichtet, teilweise schränken Gesetze diese Audit-Trails ein. Dieser Artikel fasst zusammen, worauf insbesondere Medizinproduktehersteller achten sollten, wenn sie mit Audit-Trails arbeiten. Anmerkung: Dieser Artikel verwendet die Begriffe „Audit-Trail“ und „Audit-Log“ synonym.
Details
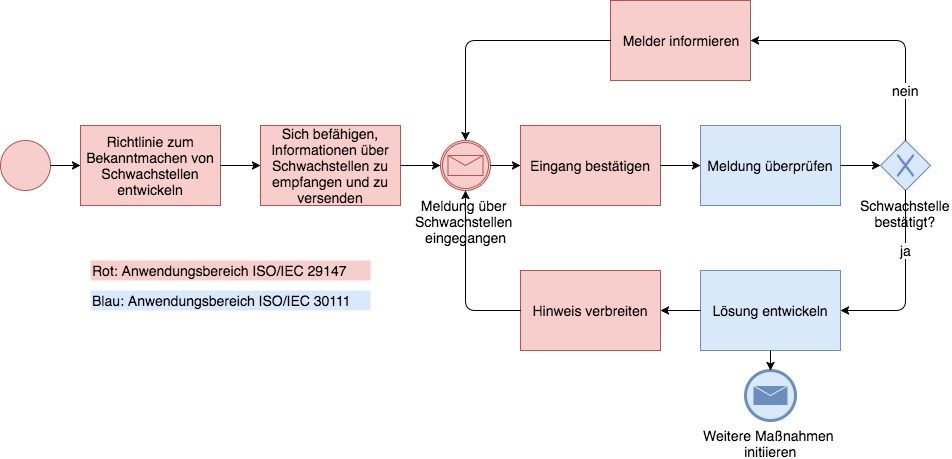
ISO 29147 – noch nie gehört? Dabei ist diese Norm gerade für Hersteller von Medizinprodukten sehr hilfreich: Sie sollten sich die ISO 29147 zunutze machen, auch um regulatorische Anforderungen zu erfüllen. Welche Anforderungen das sind und wie Sie die ISO 29147 dabei einbeziehen können, lesen Sie in diesem Beitrag.
Details
Der Health Insurance Portability and Accountability Act (HIPAA) ist ein US-amerikanisches Gesetz, das Anforderungen an den Umgang mit geschützten Gesundheitsdaten stellt. Institutionen, die in den USA diese Daten erheben oder verarbeiten, sowie deren Unterauftraggeber müssen den HIPAA befolgen, um Sanktionen zu vermeiden. Besonders für europäische Firmen ist der HIPAA ein nur schwer verständliches und kaum…
Details
Wie gefährdet die IT-Sicherheit im Gesundheitswesen ist, wissen wir nicht erst seit Februar 2016: Damals wurden die IT-Infrastrukturen vieler Kliniken durch einen einfachen Virenangriff stillgelegt. Daher achten die Behörden strenger darauf, dass nicht nur Kliniken, sondern auch Hersteller die IT-Sicherheit ihrer (Medizin-)Produkte gewährleisten. In diesem Artikel erhalten Sie einen Überblick darüber, was die IT-Sicherheit im…
Details
Seit dem 09. Juni 2021 gilt das Gesetz zur digitalen Modernisierung von Versorgung und Pflege. Es trägt auch den Titel „Digitale-Versorgung-und-Pflege-Modernisierungs-Gesetz“, kurz DVPMG. Dieses Gesetz ändert zahlreiche andere Gesetze und Verordnungen, z. B. das SGB V und die DiGAV. Dabei geht das DVPMG weit über die Einführung von digitalen Pflegeanwendungen hinaus.
MDR und IVDR fordern von den Medizinprodukteherstellern entweder einen Post-market Surveillance Report („Bericht über die Überwachung nach dem Inverkehrbringen“) oder einen Periodic Safety Update Report („Regelmäßig aktualisierter Bericht über die Sicherheit“). Den Periodic Safety Update Report kürzt man meist als „PSUR“ ab, den Post-market Surveillance Report als „PMS-Report“.
Details
Die MDR verpflichtet die Hersteller von Medizinprodukten zur Post-Market Surveillance (PMS) und damit zum Sammeln von PMS-Daten. Dieser Artikel soll zur Klärung beitragen, welche regulatorischen Anforderungen Hersteller beim Sammeln dieser PMS-Daten beachten müssen. Insbesondere soll er aufzeigen, ob Hersteller eine Ethik-Kommission einbeziehen müssen, wenn die Daten bei der Routine-Anwendung der Produkte anfallen.
Die digitale Transformation Benannter Stellen wird das Medizinprodukte-Ökosystem in den nächsten Jahren spürbar umkrempeln. Dieser Artikel beschreibt
Die Medical Device Coordination Group (MDCG) – auf Deutsch Koordinierungsgruppe Medizinprodukte – ist ein von MDR und IVDR gefordertes Expertengremium. Die MDCG wird gelegentlich mit einer anderen Koordinierungsgruppe oder mit Expertengremien (Expert Panels) verwechselt. Wie sich diese Gruppen abgrenzen, erfahren Sie hier. Lesen Sie in diesem Artikel, wie Sie von den Ergebnissen der MDCG-Arbeiten betroffen…
Details
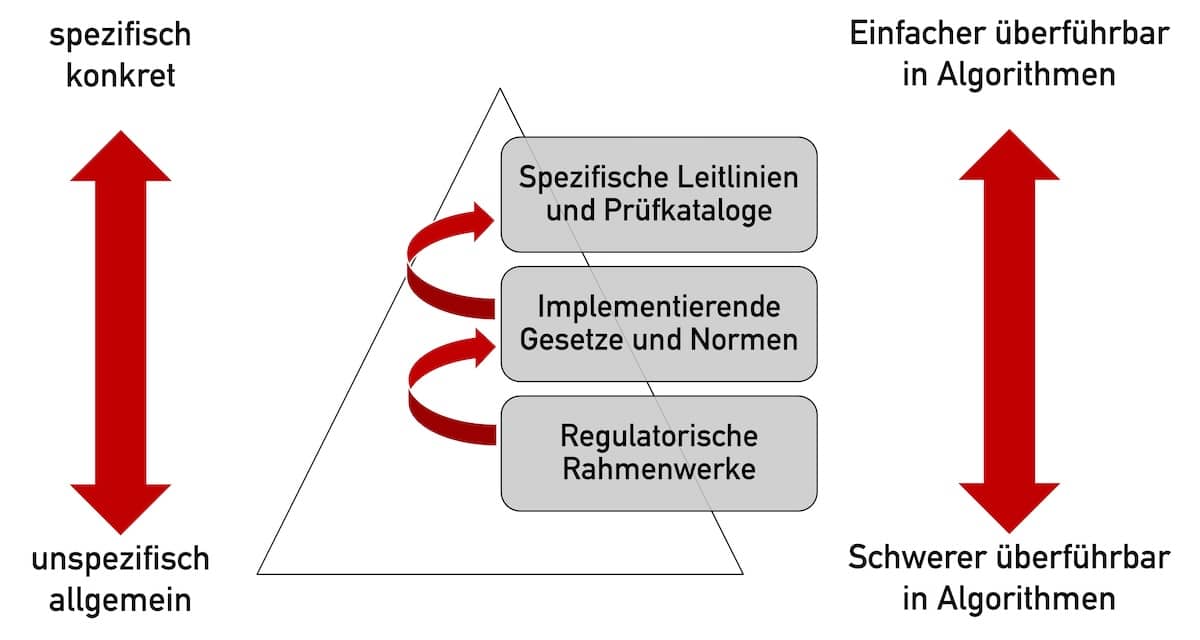
Noch immer veröffentlichen die Regulierer Gesetze und Verordnungen als Text. So wie seit Tausenden von Jahren. Regulation as Code bedeutet einen radikalen Bruch mit dieser Praxis. Ist es möglich, Gesetze in Algorithmen zu überführen? Warum wollte man dies tun? Wie sollten Sie sich als Regulierer, Hersteller, Behörde oder Benannte Stelle darauf vorbereiten? Antworten liefert dieser…
Details