Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
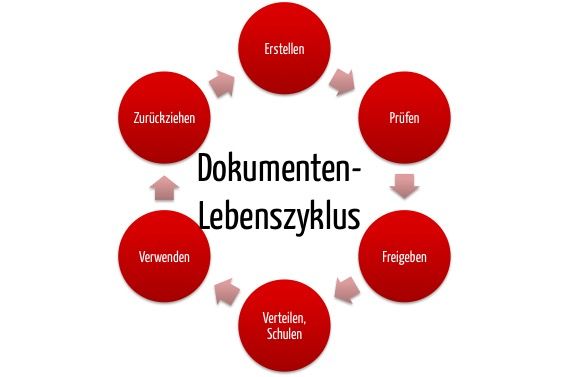
Unter Dokumentenlenkung versteht man ein dokumentiertes Verfahren, das festlegt, wie Dokumente erstellt, geprüft, genehmigt, gekennzeichnet, verteilt und aktualisiert werden. Nach ISO 9001 oder ISO 13485 zertifizierte Organisationen sind zur Dokumentenlenkung verpflichtet.
Details
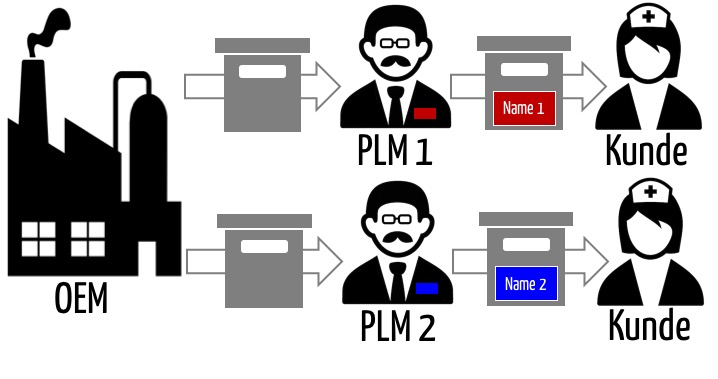
Ein Original Equipment Manufacturer (OEM) ist eine Firma, die Produkte herstellt (entwickelt, produziert), aber nicht notwendigerweise unter eigenem Namen in Verkehr bringt. Man spricht auch vom White-Labeling der Produkte. Dieser Artikel untersucht die regulatorischen Anforderungen und die Verantwortlichkeiten der OEM sowie der Firmen, die jene Produkte unter eigenem Namen in Verkehr bringen. Letztere nennt man…
Details
Die meisten Hersteller nutzen harmonisierte Normen, um die Konformität ihrer Produkte mit den grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen. Das gilt beispielsweise auch für Medizinproduktehersteller.
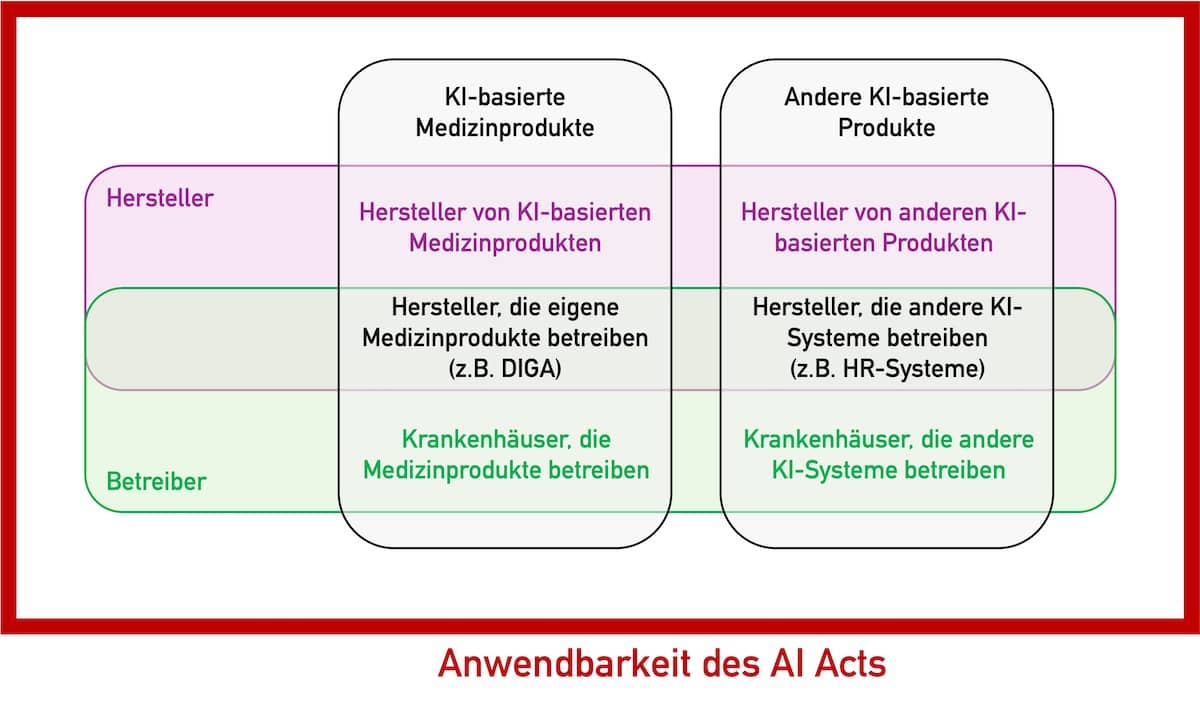
Dieser Artikel untersucht die Anwendbarkeit des AI Acts für Hersteller von Medizinprodukten und IVD, die keine KI-basierten Produkte in den Verkehr bringen. Unter anderem beantwortet er die Frage, ob ein Hersteller den AI Act beachten muss, falls er ChatGPT verwendet oder zur eigenen Nutzung ein KI-System entwickelt, das Kundenrückmeldungen klassifiziert.
Details
Die Verordnung (EU) 2025/327 über den europäischen Gesundheitsdatenraum (European Health Data Space, kurz EHDS) ist eine weitere europäische Verordnung, die Hersteller von Medizinprodukten und IVD betreffen kann. Was diese Verordnung fordert und was diese Hersteller bis wann tun müssen, klärt dieser Artikel ebenso wie mögliche Vorteile des EHDS bzw. der EHDS-VO.
Details
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und die Abgrenzung von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Die Klassifizierung von In-vitro-Diagnostika (IVD) kann weitreichende Folgen haben, da diese Einfluss auf das Konformitätsbewertungsverfahren, auf Zertifizierungsaudits und somit auf die Markteinführung hat. Damit Ihr IVD nicht unnötig einer hohen Risikoklasse zugeordnet wird, verschafft Ihnen dieser Artikel einen Überblick darüber,
Details
Weder das MPG noch die MDR treffen Regelungen zur Produkthaftung, also zur Haftung der Hersteller für Schäden, die aufgrund von Produktfehlern entstehen. Hersteller sollten sich aber bewusst sein, dass viele Rechtsnormen den Geschädigten Anspruch auf Schadenersatz zubilligen, wenn ein fehlerhaftes Medizinprodukt Patienten, Anwender oder Dritte schädigt. Die Haftung kann sich beispielsweise ergeben aus: Hohe Relevanz…
Details
Wenn Sie ein Medizinprodukt auf den Markt bringen möchten, stellt sich schnell die Frage, wie Sie vorgehen sollten und welche gesetzlichen Regelungen Sie beachten müssen. Dieser Artikel gibt Ihnen Antworten und stellt Ihnen die sieben Schritte vor, mit denen Ihnen die Inverkehrbringung Ihrer Produkte schnell und gesetzeskonform gelingt.
Details
Die Schweiz ist nicht nur ein wichtiges Herstellerland für Medizinprodukte, sondern auch ein wichtiger Markt für Medizinproduktehersteller, die ihren Sitz außerhalb der Schweiz haben. Doch seit dem 26.05.2021 (für Medizinprodukte) und seit dem 26.05.2022 (für In-vitro-Diagnostika-Produkte | IVD-Produkte) müssen sowohl die Hersteller aus der Schweiz als auch Hersteller aus anderen Märkten (z. B. der EU)…
Details