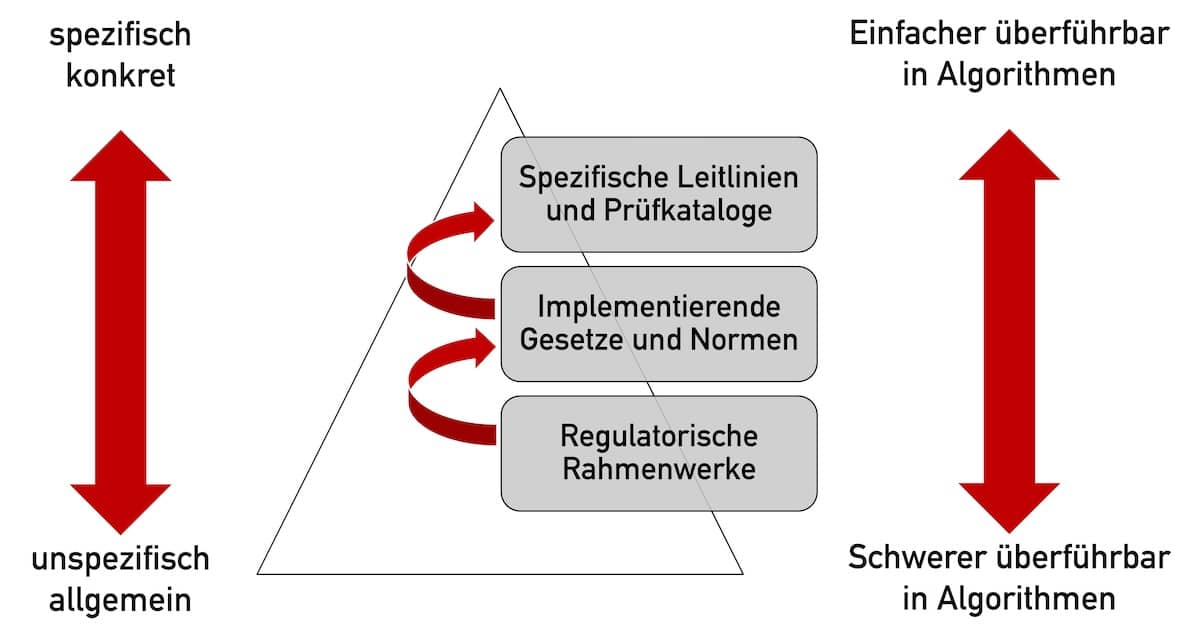
Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Sie finden hier einen Artikel über die Aufgaben und Kompetenzen von Regulatory Affairs Manager.
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Wenn regulatorische Anforderungen nicht erfüllt sind, ist häufig eine Remediation erforderlich.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Die Medical Device Coordination Group (MDCG) – auf Deutsch Koordinierungsgruppe Medizinprodukte – ist ein von MDR und IVDR gefordertes Expertengremium. Die MDCG wird gelegentlich mit einer anderen Koordinierungsgruppe oder mit Expertengremien (Expert Panels) verwechselt. Wie sich diese Gruppen abgrenzen, erfahren Sie hier. Lesen Sie in diesem Artikel, wie Sie von den Ergebnissen der MDCG-Arbeiten betroffen…
Details
Noch immer veröffentlichen die Regulierer Gesetze und Verordnungen als Text. So wie seit Tausenden von Jahren. Regulation as Code bedeutet einen radikalen Bruch mit dieser Praxis. Ist es möglich, Gesetze in Algorithmen zu überführen? Warum wollte man dies tun? Wie sollten Sie sich als Regulierer, Hersteller, Behörde oder Benannte Stelle darauf vorbereiten? Antworten liefert dieser…
Details
Die Türkei ist kein Mitgliedstaat der EU, hat aber ihre regulatorischen Anforderungen an Medizinproduktehersteller den EU-Anforderungen angeglichen. Dieser Artikel beschreibt,
Details
Am 16.07.2020 hat der Europäische Gerichtshof (EuGH) das Privacy-Shield-Abkommen für ungültig erklärt (EuGH, Urt. v. 16.7.2020; Az. C‑311/18). Das Urteil, das sozialen Medien wie Facebook Grenzen setzen sollte, hat massive Auswirkungen. Beispielsweise sind auch Medizinproduktehersteller betroffen, die Patientendaten in den Clouds der US-Techgiganten speichern.
Am 27.09.2019 hat die FDA das Guidance-Dokument zu den Medical Device Data Systems (MDDS) als neue Version veröffentlicht. Am 19. April 2021 hat sie die Klassifizierung dieser Produkte überarbeitet. Dieses Dokument erläutert, wann Ihr Produkt (z. B. Ihre Software) als MDDS zählt, wann Sie sich auf eine Überwachung durch die FDA einstellen müssen und unter…
Details
Von 2017 bis 2022 bot die FDA ausgewählten Firmen für standalone Software ein „Precertification (Pre-Cert) Pilot Program“ an, das den Zulassungsprozess von Digital Health Produkten vereinfachen und beschleunigen sollte. Weiterführende Informationen Auf Ihrer Webseite informiert die Behörde ausführlich darüber. Dieser Artikel fasst Ihnen die wichtigsten Aspekte zusammen und verschafft Ihnen einen schnellen Überblick.
Details
Decision Support Systeme, zu Deutsch Entscheidungsunterstützungssysteme, finden auch in der Medizin zunehmend Anwendung. Handelt es sich dabei um Medizinprodukte, müssen diese die gesetzlichen Anforderungen (z.B. die grundlegenden Anforderungen) erfüllen. Der Hype um die künstliche Intelligenz, insbesondere das Machine Learning, und Anwendungen wie Watson wecken Hoffnungen an die Leistungsfähigkeit von Decision Support Systemen. Dieser Artikel stellt die…
Details
Eine häufige Frage an uns: „Bieten Sie auch Computerized Systems Validation an?“ Einer der Gründe für das Interesse ist sicherlich: Behörden und Benannte Stellen machen das Thema CSV immer öfter zum Gegenstand von Audits. Lesen Sie hier, welche Regularien es zur „Computerized Systems Validation“ gibt und wie Sie deren Forderungen am elegantesten erfüllen.
Details
Werbung ist vielleicht nicht das, woran Hersteller als Erstes denken, wenn sie ein neues Medizinprodukt entwickeln. Doch auch in der Medizintechnikbranche gehört sie dazu. Zumal es schnell passiert, dass Unternehmen Werbung machen, ohne sich dessen bewusst zu sein. Wie in allen Bereichen gibt es auch in Sachen Werbung für Medtech-Hersteller einige Besonderheiten zu beachten. Was…
Details
Free Sales Certificate – Exportbescheinigung – Verkehrsfähigkeitsbescheinigung – Freihandelszertifikat – Freiverkaufszertifikat: Nicht einmal beim Namen herrscht bei den Behörden Konsens. Dennoch sind die „Free Sales Certificates“ für exportierende Hersteller wesentlich. Wann Sie ein solches Freihandelszertifikat benötigen, wie und wo Sie es erhalten und welche Voraussetzungen Sie dafür erfüllen müssen, lesen Sie in diesem Artikel.
Details