Safety Assurance Cases: Leidvolle Diskussionen mit Auditoren abkürzen
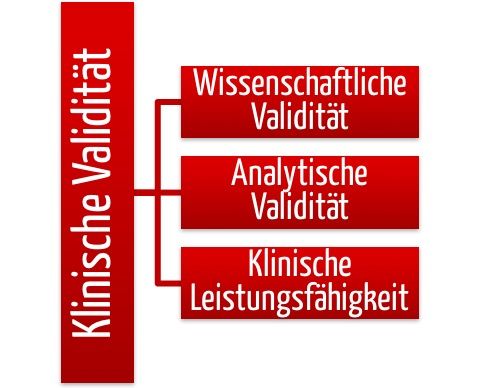
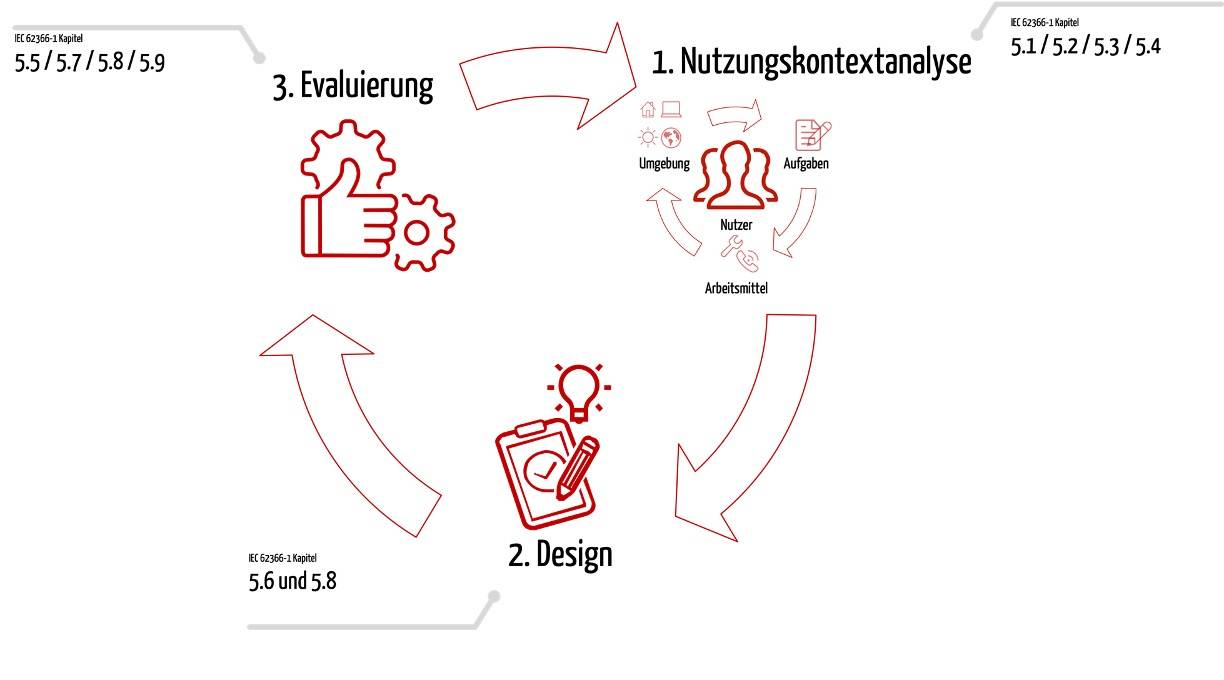
Sind Sie die Diskussionen mit Ihrer Benannten Stellen leid, ob Ihre Produkte ausreichend sicher sind? Dann wenden Sie Safety Assurance Cases an. Mit diesem Top-Down-Ansatz führen Sie leicht und elegant den nachvollziehbaren Beweis. Mit einem Ansatz konform dem AAMI TIR 38, der ISO/IEC 15026 oder den Vorgaben der FDA haben Sie die Argumente auf ihrer…
Details