Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
e) Regulatorische Rollen
Sie finden hier Fachartikel zu mehreren regulatorischen Rollen;
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
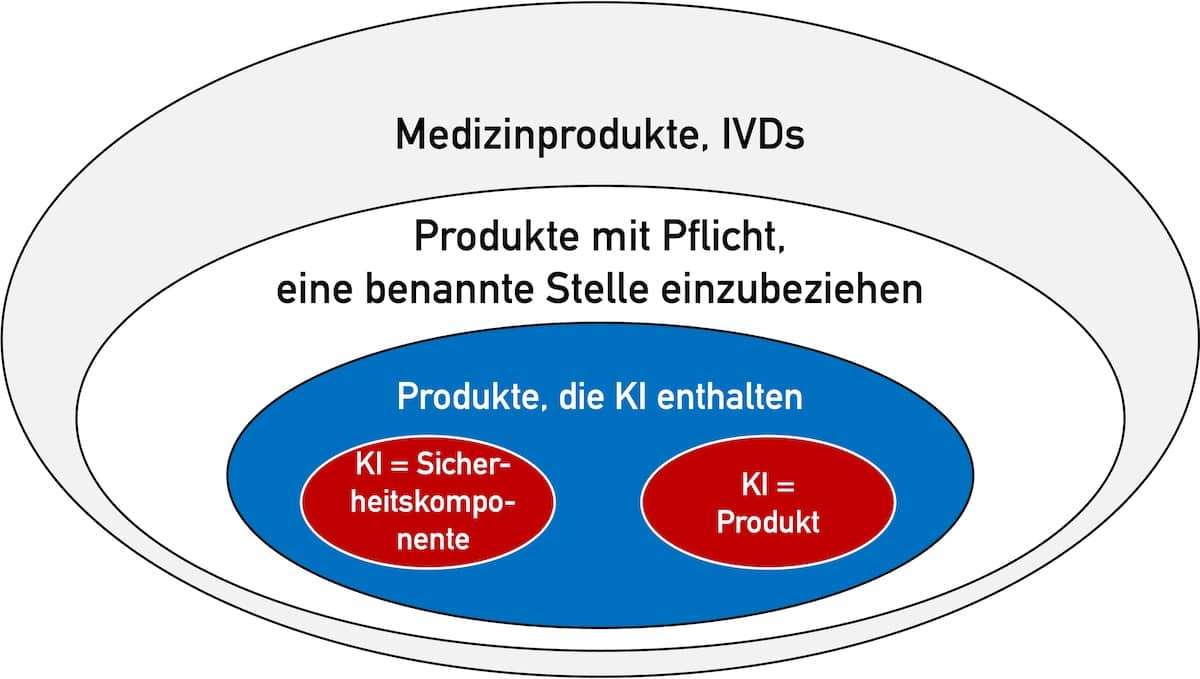
Müssen Medizinproduktehersteller eine KI wie ChatGPT validieren, die sie bei der Entwicklung, Produktion, Zulassung und Überwachung ihrer Produkte einsetzen? Falls ja, wie soll das gelingen mit Modellen, die nichtdeterministische Ergebnisse liefern? Antworten darauf und auf die Frage, was Ihre Auditoren erwarten (sollten), gibt dieser Fachartikel.
Details
Die EU-KI-Verordnung (EU AI Act) ist veröffentlicht. Viele Hersteller von Medizinprodukten und IVD sowie andere Akteure im Gesundheitswesen stehen vor der großen Aufgabe, den über 140 Seiten umfassenden Gesetzestext zu verstehen und die Anforderungen zu erfüllen. Beachten Sie: Verstöße gegen den AI Act werden mit Geldstrafen in Höhe von bis zu 7 % des jährlichen Umsatzes geahndet. Dieser…
Details
Die Klassifizierung von In-vitro-Diagnostika (IVD) kann weitreichende Folgen haben, da diese Einfluss auf das Konformitätsbewertungsverfahren, auf Zertifizierungsaudits und somit auf die Markteinführung hat. Damit Ihr IVD nicht unnötig einer hohen Risikoklasse zugeordnet wird, verschafft Ihnen dieser Artikel einen Überblick darüber,
Details
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und der Zusammenhang von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Mit dem eStar-Programm möchte die FDA die Effizienz von Zulassungsverfahren (z. B. der 510(k)-Verfahren) durch Digitalisierung erhöhen. Bei der Weiterentwicklung von eStar arbeitet das Johner Institut mit der FDA zusammen. Wie zukunftsweisend dieser Ansatz ist und ob Sie daran teilnehmen sollten oder gar müssen, erfahren Sie in diesem Artikel.
Details
Rechtliche Anforderungen und praktische Umsetzung nach MDR/IVDR EU-Bevollmächtigte unterliegen nicht nur den rechtlichen Vorgaben der MDR und IVDR. Sie haften auch für Verstöße gegen das Medizinprodukterecht. Dieser Fachartikel gibt praxisnahe Antworten auf alle regulatorischen Fragen zum EU-REP mit konkreten Handlungsempfehlungen vom führenden Beratungsunternehmen für Medizinprodukte-Regulierung. Er wendet sich an Non-EU-Medizinproduktehersteller sowie an Regulatory-Affairs-Manager, Qualitätsmanager, PRRCs…
Details
Im Dezember 2023 trat der EU Data Act in Kraft. Damit möchte sie einen neuen Rechtsrahmen für den Umgang mit Daten schaffen, der nicht nur US-Techgiganten betrifft. Der EU Data Act wird sich auf viele Firmen auswirken, die Daten verarbeiten. Auch Medizinproduktehersteller. Dieser Artikel hilft Ihnen zu beurteilen,
Details
Handelswaren im Medizinproduktebereich können für Händler zur regulatorischen Falle werden: Die Grenze zwischen Händler und Hersteller nach MDR bzw. IVDR ist schmaler, als viele denken – mit potenziell kostspieligen rechtlichen Konsequenzen.
Die EU-Verordnung 2017/745 (MDR) legt die allgemeinen Anforderungen an die Gebrauchsanweisung (instructions for use, kurz IFU) fest. Ob sie auch in elektronischer Form vorliegen darf (eIFU), regelt die Durchführungsverordnung (EU) 2021/2226. Diese wurde durch die Durchführungsverordnung (EU) 2025/1234 überarbeitet. Eine konsolidierte Version ist mittlerweile ebenfalls verfügbar. Wir haben die Voraussetzungen für die elektronische Gebrauchsanweisung für Sie…
Details
Eine Orientierungshilfe, basierend auf Erfahrungen von Oliver Hilgers, Stefan Bolleininger und dem Johner Institut Die Diskussionen um Klasse-I-Software reißen nicht ab. Dieser Artikel gibt eine Hilfestellung bei der Klassifizierung von medizinischer Software nach den Regeln der MDR.
Details