Der Bereich „Regulatory Affairs“ umfasst über 200 Aufgaben, die bei der Entwicklung und Zulassung von Medizinprodukten zu erledigen sind.
Sie finden hier eine Übersicht über die wichtigsten Inhalte, damit Sie Ihr Produkt schnell zulassen können.
Inhalt
Sie finden auf dieser Seite Fachartikel zu diesen Themen:
- Was Regulatory Affairs ist
- Regulatorische Anforderungen
- Zulassung und Dokumentation
- Behörden, Institutionen und Verbänden
- Weitere Themen der Regulatory Affairs
1. Was Regulatory Affairs ist
Regulatory Affairs umfasst die Prozesse und Aktivitäten, die sicherstellen, dass Medizinprodukte die regulatorischen Anforderungen der Länder erfüllen, in denen sie verkauft werden sollen. Dazu gehören die
- Einholung der erforderlichen Genehmigungen und Freigaben von den Aufsichtsbehörden,
- Einhaltung der geltenden Vorschriften und Normen sowie
- Aufrechterhaltung der Konformität während des gesamten Produktlebenszyklus bis zur Außerbetriebnahme.
Zu den Aufgaben des Bereichs Regulatory Affairs gehört auch die Überwachung von Änderungen der Vorschriften und Normen und die Kommunikation dieser Änderungen mit den Interessengruppen innerhalb des Unternehmens, um eine kontinuierliche Einhaltung zu gewährleisten.
Damit spielt Regulatory Affairs eine entscheidende Rolle, wenn es darum geht, sicherzustellen, dass Medizinprodukte sicher und wirksam sind und den gesetzlichen Anforderungen entsprechen.
2. Regulatorische Anforderungen
a) Deutschland
b) Europa
c) USA
d) Andere Märkte
3. Zulassung und Dokumentation
a) Zulassung
Finden Sie weitere Informationen zur internationalen Zulassung.
b) Qualifizierung und Klassifizierungen (Wie ist mein Produkt einzuteilen?)
c) Technische Dokumentation (Was muss ich pro Produkt dokumentieren?)
d) Qualitätsmanagement (Was sollte Ihre Firma erfüllen?)
Das Qualitätsmanagement zählt üblicherweise nicht zur Verantwortung von Regulatory Affairs. Dennoch listen wir Ihnen einige wichtige Artikel.
e) Regulatorische Rollen
Sie finden hier Fachartikel zu mehreren regulatorischen Rollen;
4. Behörden, Institutionen und Verbände
a) Deutschland
| BfArM: Bundesamt für Arzneimittel und Medizinprodukte |
| DIMDI (Deutsches Institut für medizinische Informatik; wurde inzwischen in das BfArM integriert) |
| DAkkS, die deutsche Akkreditierungsstelle |
| Länderbehörden: Regierungspräsidien, Gewerbeaufsichtsämter, Regierungen |
b) Europa
c) International
| IMDRF: International Medical Device Regulators Forum |
5. Regulatory Affairs: Weitere Themen
Die Aufgaben von Regulatory Affairs umfassen auch das Finden und Beseitigen von Abweichungen und Nicht-Konformitäten. Die (notfallmäßige) Beseitigung nennt sich Remediation.
Beachten Sie die Vor- und Nachteile von Regulatory Information Management Systemen (RIMS) und deren Rolle bei der digitalen Transformation der Hersteller.
Ein Teil der Aufgaben von Regulatory Affairs ist die Regulatory Intelligence.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Zulassung Ihrer Produkte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Falls Sie Unterstützung dabei wünschen, Ihre Medizinprodukte gesetzeskonform zu entwickeln und „zuzulassen“, dann nehmen Sie gleich Kontakt auf. Das Team das Johner Instituts hilft gerne!
Die EN ISO 14155:2020 ist eine für die MDR bisher nicht harmonisierte Norm mit dem Titel „Clinical investigations of medical devices for human subjects – good clinical practice”. Auf Deutsch: „Klinische Prüfung von Medizinprodukten – Gute klinische Praxis“. Sie beschreibt somit für Medizinproduktehersteller den Stand der Technik bei der Vorbereitung, Planung, Durchführung und Auswertung klinischer…
Details
Der Brexit wurde mit dem 01.01.2021 vollzogen. Was für manche ein Grund zum Feiern war, bedeutet für viele eine zusätzliche Last – auch für die Hersteller von Medizinprodukten. Für Hersteller ist es wichtig zu verstehen, welche regulatorischen Anforderungen sie erfüllen müssen und von welchen Übergangsfristen sie profitieren, wenn sie ihre Produkte weiterhin in Großbritannien verkaufen…
Details
Die European Medical Device Nomenclature (EMDN) ist neben Universal Medical Device Nomenclature System (UMDNS) eines von mehreren Systemen, um Medizinprodukte zu kodieren. Genau wie MDA/MDN-Codes (s. EU-Durchführungsverordnung (EU) 2017/2185) werden diese Systeme bei regulatorischen Prozessen benötigt, z. B. bei Registrierung und Vigilanz. Dieser Artikel stellt die Kodiersysteme und deren gesetzlich vorgeschriebene Anwendung vor.
Details
Regulatory Affairs Manager kümmern sich um die Zulassung von Medizinprodukten. Lesen Sie in diesem Artikel, Update: Auswirkungen der digitalen Transformation auf die Aufgaben der Regulatory Affairs Manager ergänzt!
Details
Die ISO 19011 ist der internationale Leitfaden für die Auditierung von Managementsystemen. Daher betrachtet Ihre Benannte Stelle die ISO 19011 als Stand der Technik, wenn sie bei Ihnen im ISO 13485-Zertifizierungsaudit prüft, ob Sie Ihre internen Audits und Lieferantenaudits wirksam durchführen. Folglich sollten insbesondere die Qualitätsmanagement-Verantwortlichen die ISO 19011 kennen und berücksichtigen. Dabei hilft dieser…
Details
Die C5-Testate sind für Leistungserbringer und ggf. für Medizinproduktehersteller relevant. Denn das Anfang 2024 in Kraft getretene Digital-Gesetz (DigiG) definiert die Anforderungen an Cloud-Dienste im Gesundheitswesen neu. Dieser Artikel erklärt die wichtigsten Aspekte der C5-Zertifizierung bzw. C5-Testate für Medizinproduktehersteller und Leistungserbringer wie etwa Krankenhäuser.
Details
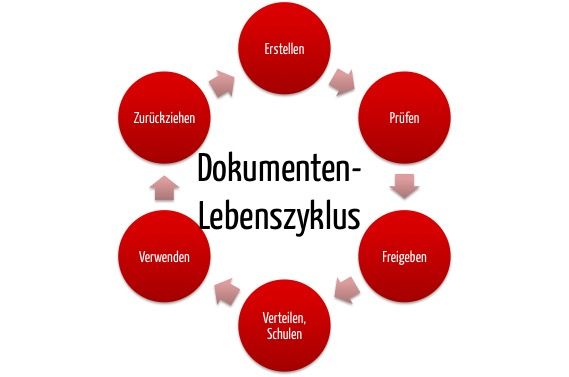
Unter Dokumentenlenkung versteht man ein dokumentiertes Verfahren, das festlegt, wie Dokumente erstellt, geprüft, genehmigt, gekennzeichnet, verteilt und aktualisiert werden. Nach ISO 9001 oder ISO 13485 zertifizierte Organisationen sind zur Dokumentenlenkung verpflichtet.
Details
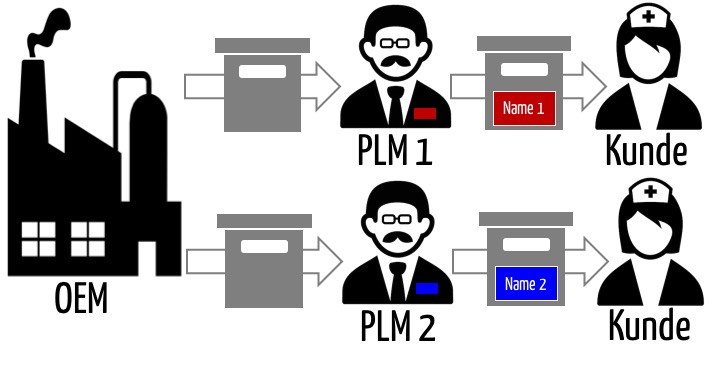
Ein Original Equipment Manufacturer (OEM) ist eine Firma, die Produkte herstellt (entwickelt, produziert), aber nicht notwendigerweise unter eigenem Namen in Verkehr bringt. Man spricht auch vom White-Labeling der Produkte. Dieser Artikel untersucht die regulatorischen Anforderungen und die Verantwortlichkeiten der OEM sowie der Firmen, die jene Produkte unter eigenem Namen in Verkehr bringen. Letztere nennt man…
Details
Die meisten Hersteller nutzen harmonisierte Normen, um die Konformität ihrer Produkte mit den grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen. Das gilt beispielsweise auch für Medizinproduktehersteller.
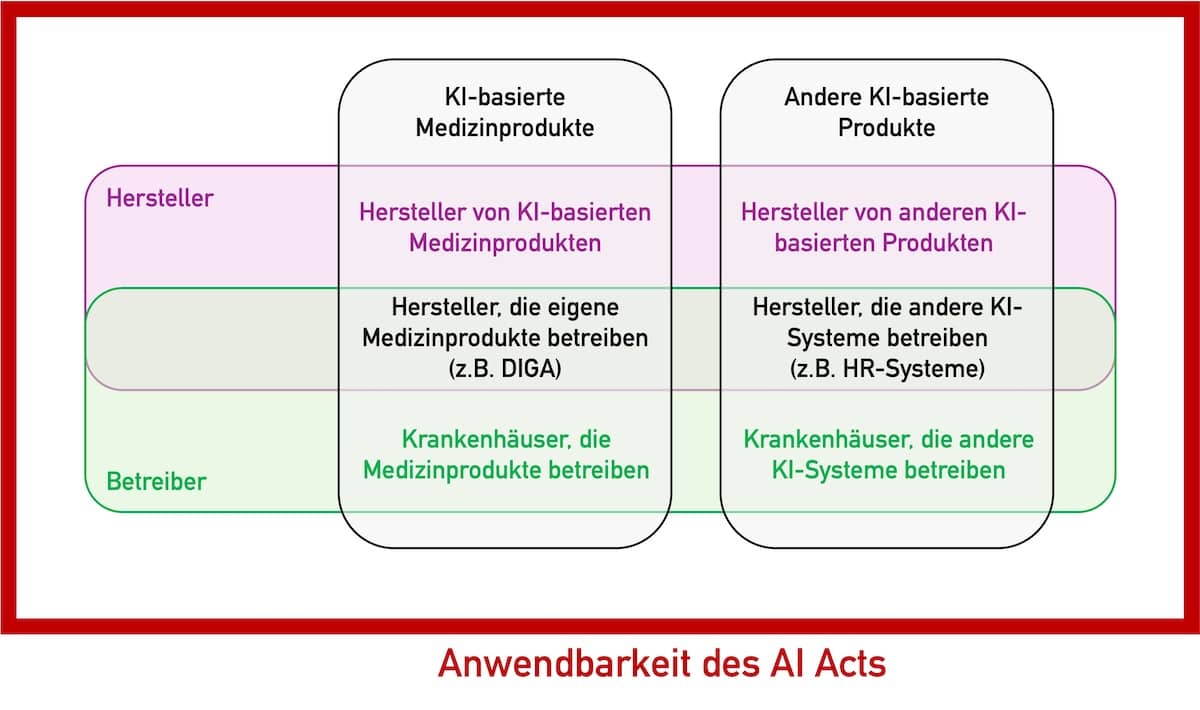
Dieser Artikel untersucht die Anwendbarkeit des AI Acts für Hersteller von Medizinprodukten und IVD, die keine KI-basierten Produkte in den Verkehr bringen. Unter anderem beantwortet er die Frage, ob ein Hersteller den AI Act beachten muss, falls er ChatGPT verwendet oder zur eigenen Nutzung ein KI-System entwickelt, das Kundenrückmeldungen klassifiziert.
Details